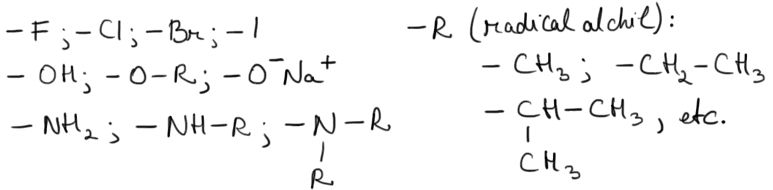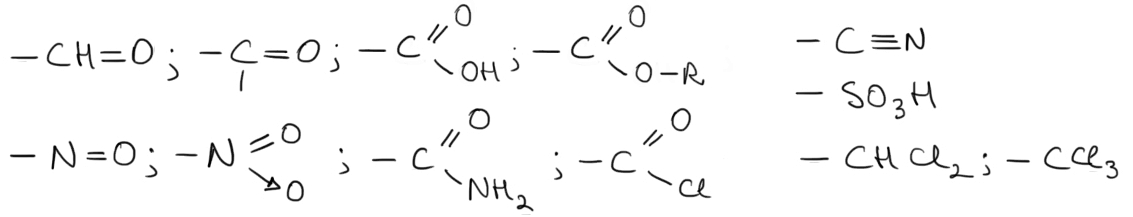Arene – proprietăţi chimice (substituţie la nucleul aromatic)
Partajeaza in Google Classroom
Teorie: Teorie - Proprietăţile chimice ale arenelor – partea I Descarcă PDF
Există două mari categorii de reacţii chimice la care iau parte arenele: reacţiile caracteristice nucleului aromatic (reacţii de substituţie, adiţie, şi oxidare), şi reacţiile caracteristice catenei laterale (reacţii de substituţie şi de oxidare).
Reacţiile la nucleul benzenic sunt reacţiile specifice hidrocarburilor aromatice.
Reacţiile de substituţie la nucleul benzenic sunt reacţii prin care un atom de hidrogen din nucleul benzenic este înlocuit cu un atom al unui alt element, sau cu o grupare de atomi, iar nucleul benzenic nu suferă nicio modificare. Aceste reacţii decurg în condiţii diferite şi prin mecanisme de reacţie diferite faţă de reacţiile de substituţie ale hidrocarburilor saturate.
În molecula benzenului, cei 6 atomi de hidrogen sunt echivalenţi, şi oricare dintre ei poate fi înlocuit. Astfel, rezultatul reacţiei de substituţie este un singur compus monosubstituit. Însă, dacă e vorba de o reacţie de substituţie la un compus monosubstituit, atunci substituţia va fi orientată şi dependentă de structura primului substituent.
Orientarea reacţiei de substituţie
Există două clase de substituenţi: substituenţi de ordinul I, şi substituenţi de ordinul II.
|
Substituenţii de ordinul I (cu excepţia halogenilor): activează nucleul aromatic |
|
|
|
Substituenţii de ordinul II: dezactivează nucleul aromatic |
|
|
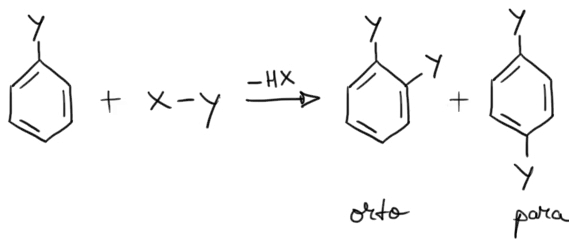
Dacă substituentul deja existent în molecula compusului participant la reacţie este un substituent de ordinul I, atunci următorul substituent va fi orientat în poziţiile orto şi para faţă de primul substituent.
Dacă substituentul deja existent este un substituent de ordinul II, atunci următorul substituent va fi orientat în poziţia meta.
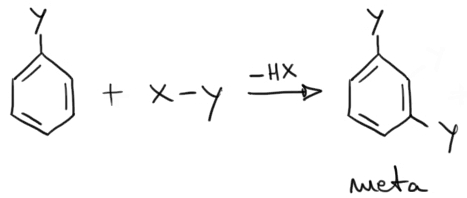
Nucleul benzenic poate fi substituit cu unu, doi sau chiar mai mulţi substituenţi. Pe nucleul benzenic putem introduce maxim 6 atomi de halogen şi până la 3 grupări alchil, nitro sau acid sulfonic.
Reacţia de halogenare a benzenului are loc prin tratarea benzenului cu Cl2 sau cu Br2, în prezenţă de clorură de fier (III) sau clorură de aluminiu drept catalizator. Pot fi folosiţi şi alţi catalizatori precum bromura de fier (III) sau bromura de aluminiu. Se obţine benzenul monohalogenat. În exces de halogen, la temperaturi ridicate, se pot obţine derivaţi dihalogenaţi, trihalogenaţi, şi până la derivaţi hexahalogenaţi.
Naftalina poate avea 2 derivaţi monosubstituiţi diferiţi, α şi β, în funcţie de poziţia atomului de carbon la care se face substituţia. Poziţia α este mai reactivă decât poziţia β.
Reacţia de nitrare este o reacţie de substituţie la nucleul benzenic prin care un atom de hidrogen este substituit cu o grupă nitro (–NO2). Se obţin nitroderivaţi ai arenelor, care au următoarea formulă generală: Ar – NO2.
Reacţia de sulfonare este o reacţie de substituţie la nucleul benzenic prin care un atom de hidrogen este substituit cu o grupă sulfonică (–SO3H). Se obţin acizi arilsulfonici, care au următoarea formulă generală: Ar – SO3H. Spre deosebire de reacţiile de nitrare şi halogenare, reacţia de sulfonare este o reacţie reversibilă.
Reacţia de alchilare este reacţia prin care un atom de hidrogen dintr-un nucleu aromatic este înlocuit cu un radical alchil. Charles Friedel şi James Crafts sunt chimiştii care au descoperit această reacţie, de aceea reacţia de alchilare în variantă clasică se numeşte alchilare Friedel-Crafts. Prin alchilarea arenelor se obţin arene cu catenă laterală. Alchilarea se poate face în mai multe feluri:
- alchilare cu derivaţi halogenaţi de tipul radical alchil – halogen, în prezenţă de clorură de aluminiu anhidră;
- alchilare cu alchene inferioare precum etena sau propena, în prezenţă de clorură de aluminiu cu urme de apă;
- alchilare cu alcooli, în prezenţă de acid sulfuric.
Acilarea Friedel-Crafts este reacţia prin care un atom de hidrogen dintr-un nucleu aromatic este substituit cu o grupă acil. Formula generală a grupei acil este: R – C = O. Acilarea arenelor se poate face cu derivaţi funcţionali ai acizilor carboxilici sau cu anhidride ale acizilor carboxilici.