Forţe intermoleculare. Legături de hidrogen.
Partajeaza in Google Classroom
Teorie: Teorie - Forțe intermoleculare. Legătura de hidrogen. Descarcă PDF
Forțe intermoleculare. Legătura de hidrogen.
Forțele intramoleculare sunt forțele care țin împreună atomii sau ionii care formează compușii chimici. Acestea sunt legăturile covalente (polare, nepolare și coordinative) și legăturile ionice. Așadar, forțele intramoleculare se referă la acele forțe care acționează în interiorul moleculei.
Forțele intermoleculare sau interacțiunile intermoleculare sunt forțele care acționează între moleculele, atomii sau ionii unei substanțe și sunt responsabile de starea de agregare și de proprietățile fizice ale substanțelor. Cele mai importante forțe intermoleculare sunt următoarele:
- Legăturile de hidrogen;
- Interacțiile dipol-dipol;
- Forțele de dispersie London.
Interacțiile dipol-dipol și forțele de dispersie London se mai numesc și forțe van der Waals.
Forțele intermoleculare sunt mult mai slabe decât forțele intramoleculare. Cu toate acestea, de tăria forțelor intermoleculare depind starea de agregare a substanțelor cât și proprietățile lor fizice, precum temperaturile de fierbere și de topire, sau presiunea de vapori.
|
|
|
|
|
Forțe intermoleculare slabe: stare gazoasă |
Forțe intermoleculare mai puternice decât în cazul gazelor: stare lichidă |
Forțe intermoleculare puternice: stare solidă |
Trecerea unei substanțe din stare solidă în stare lichidă și apoi în stare gazoasă presupune învingerea forțelor dintre moleculele substanței respective. Acest lucru se poate îndeplini prin schimbarea temperaturii sau a presiunii.
Punctele de topire și de fierbere ale unei substanțe se referă la temperatura la care o substanță se topește, respectiv temperatura la care o substanță fierbe.
Punctele de topire ale compușilor ionici sunt foarte ridicate datorită forțelor de atracție electrostatică foarte puternice dintre ioni.
Punctele de topire și de fierbere ale compușilor moleculari sunt mai mici decât cele ale compușilor ionici.
În cazul substanțelor moleculare, starea de agregare cât și alte proprietăți fizice, depind și de masa moleculelor care formează substanța. Într-o serie de compuși cu structuri asemănătoare, creșterea masei moleculare duce la creșterea punctelor de topire și de fierbere în seria respectivă. Însă anumite substanțe între moleculele cărora se formează legături de hidrogen au comportamente și proprietăți diferite.
Legăturile de hidrogen sunt cele mai puternice dintre forțele intermoleculare și sunt interacțiuni de natură electrostatică ce se stabilesc atunci când un atom de hidrogen legat covalent de un atom puternic electronegativ cu volum atomic mic se află în vecinătatea altui atom puternic electronegativ care are o pereche de electroni neparticipanți. Se stabilesc, deci, între molecule polare care conțin hidrogen și atomi puternic electronegativi cu volum atomic mic, de obicei, atomi de O, N sau F. Așadar, exemple de molecule între care se formează legături de hidrogen sunt H2O, HF, NH3.
Substanțele între moleculele cărora se stabilesc legături de hidrogen au anumite proprietăți prin care se deosebesc de alți compuși cu masă moleculară apropiată. Spre exemplu, aceste substanțe sunt solubile în solvenți cu ale căror molecule pot forma legături de hidrogen; de asemenea, aceste substanțe au valorile punctelor de topire și de fierbere mai ridicate.
Deși sunt interacțiuni mai slabe decât interacțiunile intramoleculare precum legăturile covalente și ionice, legăturile de hidrogen joacă un rol extrem de important în menținerea integrității structurale a numeroase molecule importante din organismele vii: proteine, enzime, acizi nucleici.
Modul în care se formează legături de hidrogen între moleculele de apă:
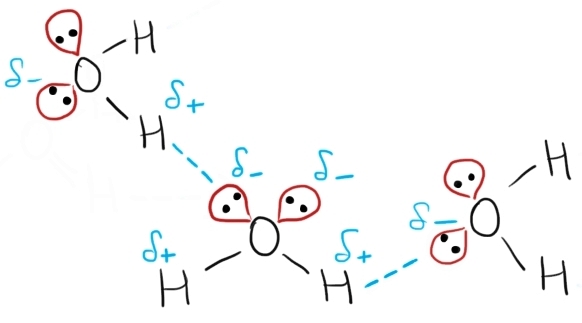
- Oxigenul este atomul cu electronegativitatea cea mai mare din molecula de apă, așadar, electronii celor două legături covalente cu atomii de hidrogen sunt mai puternic atrași către atomul de oxigen. Consecința este formarea a doi dipoli: fiecare atom de hidrogen are un pol pozitiv (sarcină parțială pozitivă), iar oxigenul este polul negativ (sarcină parțială negativă).
- În plus, oxigenul are două perechi de electroni neparticipanți la legătura covalentă, perechi ce vor atrage alți atomi de hidrogen.
- Când moleculele de apă se apropie, între polul negativ al uneia și polul pozitiv al alteia se stabilește o forță de atracție electrostatică, adică o legătură de hidrogen.
- Legăturile de hidrogen dintre molecule se simbolizează printr-o linie punctată între atomii între care se stabilește interacțiunea intermoleculară.
Variația tăriei legăturilor de hidrogen dintre moleculele de HF, H2O și NH3:
Legăturile de hidrogen dintre moleculele de HF au cea mai mare tărie, urmează tăria legăturilor dintre moleculele de apă, iar cele mai slabe legături de hidrogen se formează între moleculele de amoniac.