Legătura covalentă şi compuşii moleculari
Partajeaza in Google Classroom
Teorie: Teorie - Legătura covalentă și compușii moleculari Descarcă PDF
Legătura covalentă și compușii moleculari
Legătura covalentă este un tip de legătură chimică care se realizează atunci când doi atomi pun în comun electroni. Electronii puși în comun sunt electroni necuplați (neîmperecheați), din stratul de valență. Legăturile covalente sunt legături chimice reale, rigide și orientate în spațiu. Există două tipuri de legături covalente:
- formate între atomi identici ai unui element cu electronegativitate ridicată (nemetale), numite legături covalente nepolare;
- formate între atomi diferiți care au electronegativități apropiate ca valoare, numite legături covalente polare.
Compușii moleculari sunt compușii chimici care conțin legături covalente între atomii componenți, și se formează când atomii pun în comun electroni din straturile lor de valență.
O legătură covalentă corespunde unei perechi de electroni puși în comun de doi atomi. Perechea de electroni se numește dublet de electroni și se reprezintă printr-o linie care unește cei doi atomi participanți la legătură.
Legătura covalentă nepolară se stabilește între atomi identici de nemetale, iar dubletul de electroni este uniform atras de atomii participanți. Astfel de legături nepolare se pot forma și între atomi de nemetale diferiți, dar care formează molecule simetrice (de exemplu: CO2, CH4, CCl4).
Molecula covalentă nepolară este o moleculă în care nu există zone distincte de sarcină electrică pozitivă sau negativă, deci nu există poli. Dubletul de electroni al legăturii covalente nepolare aparține în egală măsură atomilor participanți datorită electronegativităților identice.
Legăturile covalente nepolare simple sunt legăturile în care fiecare atom participă cu un singur electron; atomii împart o singură pereche de electroni. Exemplu: H2, F2, Cl2, etc.
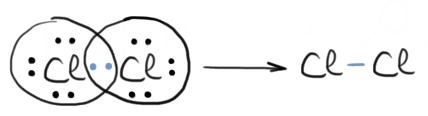
Formarea unei legături nepolare simple între doi atomi de clor. Se observă cum prin punerea în comun a unei perechi de electroni, ambii atomi de clor au o configurație de octet pe stratul de valență.
Legăturile covalente nepolare multiple sunt legăturile în care atomii participă cu doi sau trei electroni; atomii împart două sau trei perechi de electroni.
- legătură covalentă nepolară dublă: de exemplu, în cazul moleculei de O2, atomii de oxigen împart 2 perechi de electroni, fiecare atom participând la legătură cu câte 2 e- necuplați;
- legătura covalentă nepolară triplă: de exemplu, în cazul moleculei de N2, atomii de azot împart 3 perechi de electroni, fiecare atom participând la legătură cu câte 3 e- necuplați.
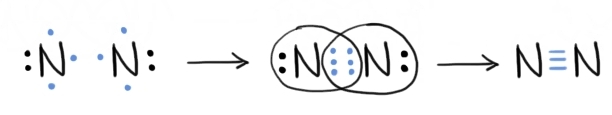
Formarea legăturii nepolare triple între doi atomi de azot.
Legătura covalentă polară se stabilește între atomi de nemetale cu electronegativitate diferită, deci între atomi diferiți.
Moleculele covalente polare sunt molecule neutre, per total, însă sarcina electrică nu este distribuită egal în moleculă – electronii puși în comun nu sunt distribuiți uniform între atomii participanți la legăturile covalente, ei preferând să fie mai apropiați de atomul cu electronegativitatea cea mai mare din moleculă. Consecința este apariția dipolilor.
Dipolul (în chimie) se referă la separarea sarcinilor electrice dintre doi atomi legați covalent, în cadrul unei molecule. Dipolii apar în cazul moleculelor polare deoarece electronii preferă să fie mai apropiați de atomul cu electronegativitate mai mare, generând o zonă de sarcină parțial negativă în jurul acestuia (notată cu δ-). În jurul atomilor mai puțin electronegativi, unde densitatea de electroni este mai mică, se generează zone de sarcină parțial pozitivă (notate cu δ+).
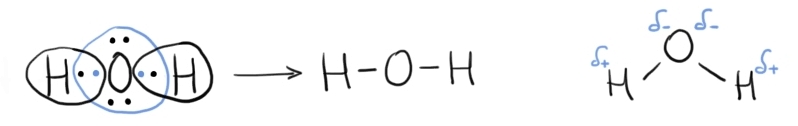
Formarea unei molecule polare – molecula de apă.
Determinarea tipului de legături chimice – cu ajutorul diferenței dintre valorile electronegativităților atomilor:
- dacă diferența de electronegativitate este mai mare decât 2, atunci este vorba de o legătură ionică;
- dacă diferența de electronegativitate este între 0,4 și 2, atunci este vorba de o legătură covalentă polară;
- dacă diferența este mai mică decât 0,4, atunci este vorba de o legătură covalentă nepolară.
Moleculele cu structură simetrică sunt molecule nepolare. Deși legăturile dintre atomi sunt polare, geometria regulată a unei astfel de molecule face ca rezultanta forțelor din dipolii formați să fie zero. Astfel, per total, o moleculă simetrică va fi nepolară, chiar dacă este formată din atomi diferiți. Exemple de astfel de molecule: CO2, CH4, CCl4.






