Legea vitezei de reacţie
Tag-uri
Partajeaza in Google Classroom
Teorie: Teorie - Legea vitezei de reacţie Descarcă PDF
Viteza de reacţie reprezintă viteza cu care concentraţiile reactanţilor scad în timp, sau viteza cu care concentraţiile produşilor cresc în timp. Viteza de reacţie poate fi determinată numai experimental.
Viteza unei reacţii depinde de variabile care pot fi controlate:
- presiune;
- temperatură;
- prezenţa catalizatorilor;
- concentraţia reactanţilor.
Influenţa concentraţiei reactanţilor asupra vitezei de reacţie: creşterea concentraţiei reactanţilor determină creşterea vitezei de reacţie.
Legea vitezei de reacţie exprimă relaţia matematică dintre concentraţiile iniţiale ale reactanţilor şi viteza la care aceştia reacţionează.
Pentru o reacţie de forma generală aA + bB 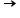 produşi de reacţie, legea vitezei de reacţie este următoarea:
produşi de reacţie, legea vitezei de reacţie este următoarea:
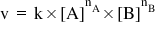
v – viteza de reacţie;
k – constanta de viteză;
[A], [B] – concentraţiile reactanţilor;
nA, nB – ordinele parţiale de reacţie în raport cu A, respectiv B.
Ordinul de reacţie în raport cu un reactant sau ordinul parţial de reacţie arată în ce manieră variază viteza de reacţie cu variaţia concentraţiei acelui reactant. La fel ca viteza de reacţie, şi ordinele parţiale de reacţie pot fi determinate numai experimental, şi nu pot fi deduse din ecuaţia reacţiei chimice.
Legea vitezei unei reacţii este o ecuaţie care exprimă viteza de reacţie ca o funcţie de concentraţiile tuturor speciilor prezente în sistemul chimic la un moment dat:
v = f([A], [B], ...)
Ordinul total de reacţie, n, se obţine prin adunarea ordinelor parţiale de reacţie. Aşadar, pentru cazul de mai sus:
nA + nB = n
Ordinul de reacţie nu este întotdeauna număr întreg – multe reacţii în fază gazoasă au ordin de reacţie fracţionar.
Exemplu – Ordinul total de reacţie şi semnificaţia unui ordin parţial de reacţie:
Pentru o lege a vitezei de forma: 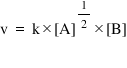
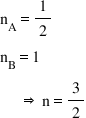
Fiecare valoare a ordinelor parţiale de reacţie oferă informaţii despre cum variază viteza de reacţie în funcţie de reactantul respectiv. De exemplu, faptul ca nB = 1 înseamnă că de câte ori creşte concentraţia reactantului B, de atâtea ori creşte şi viteza de reacţie (viteza de reacţie variază direct proporţional cu concentraţia reactantului B).
Dacă pentru o reacţie de forma generală aA + bB 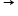 produşi de reacţie avem o lege a vitezei în care ordinele parţiale de reacţie sunt egale cu coeficienţii stoechiometrici (nA=a, nB=b), atunci reacţia are un mecanism foarte simplu, descris chiar de ecuaţia reacţiei. Acest lucru se întâmplă rar.
produşi de reacţie avem o lege a vitezei în care ordinele parţiale de reacţie sunt egale cu coeficienţii stoechiometrici (nA=a, nB=b), atunci reacţia are un mecanism foarte simplu, descris chiar de ecuaţia reacţiei. Acest lucru se întâmplă rar.
Dacă ordinele parţiale de reacţie nu sunt egale cu coeficienţii stoechiometrici (nA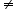 a, nB
a, nB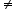 b), atunci reacţia decurge după un mecanism de reacţie mai complex decât cel indicat de ecuaţia reacţiei, deci în mai multe etape.
b), atunci reacţia decurge după un mecanism de reacţie mai complex decât cel indicat de ecuaţia reacţiei, deci în mai multe etape.






