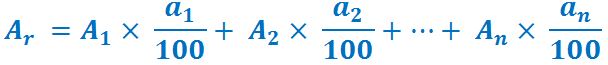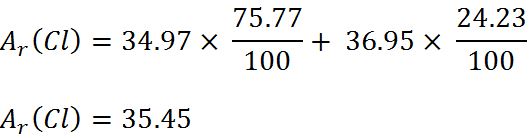Masă atomică. Izotopi. Mol de atomi
Partajeaza in Google Classroom
Teorie: Teorie - Masa atomică. Izotopi. Mol de atomi. Descarcă PDF
Masa atomică. Izotopi. Mol de atomi.
Izotopii sunt specii de atomi care au acelaşi număr atomic Z, dar au numărul de masă A diferit. Asta presupune acelaşi număr de protoni, dar număr diferit de neutroni.
Pentru că au acelaşi număr de protoni, izotopii unui element chimic au aceleaşi proprietăţi chimice şi aparţin în acelaşi loc în tabelul periodic.
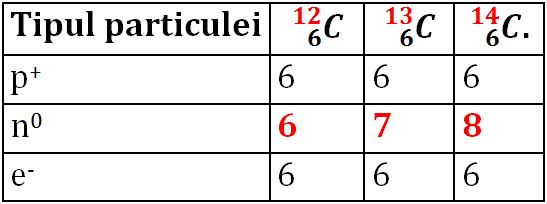
Exemplu – Numărul de particule subatomice în cazul izotopilor elementului carbon:
În natură, elementul carbon se găseşte sub forma a trei izotopi, 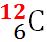
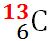
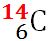
Masele atomilor se exprimă sub formă de multipli ai unităţii atomice de masă. Unitatea atomică de masă, se notează cu u sau u. a. m. şi este egală, prin convenţie, cu a 12-a parte din masa unui atom al izotopului de carbon 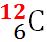
Masa atomică relativă medie este valoarea trecută în tabelul periodic în dreptul fiecărui element, şi este, de obicei, un număr raţional (a nu se confunda cu numărul de masă A care este un număr întreg). În cazul unui element chimic care se găseşte în natură sub forma a mai mulţi izotopi stabili, masa atomică relativă medie este dependentă de:
- masa atomică relativă a fiecărui izotop (A1, A2 … An);
- procentul sau abundenţa izotopului în compoziţia elementului în natură (a1%, a2% … an%).
Masa atomică relativă medie se calculează cu următoarea relaţie matematică:
Exemplu – Calculul masei atomice în cazul elementului clor:
Masa atomică relativă medie a elementului clor este ACl = 35.45; clorul se găseşte în natură sub forma a doi izotopi stabili, 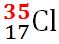
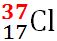
Izotopul 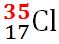
Izotopul 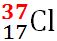
Tabelul de mai jos prezintă masele izotopilor clorului şi procentul lor în compoziţia elementului în natură.
|
Izotop |
Masa izotopului (u. a. m.) |
Compoziţia procentuală |
|
|
34.97 |
75.77 % |
|
|
36.95 |
24.23 % |
Astfel, masa atomică relativă medie a clorului va fi:
Molul este o unitate de măsură care ia în considerare dimensiunile extrem de mici ale atomilor şi face trecerea către lumea vizibilă, mai uşor de înţeles.
Un mol de atomi reprezintă cantitatea, în grame, dintr-o substanţă simplă care conţine 6.022.x.1023 atomi. Se mai numeşte şi atom gram.
Numărul lui Avogadro, notat cu NA, este egal cu 6.022.x.1023 atomi şi reprezintă numărul de atomi conţinuţi în exact 12g ai izotopului de carbon 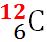
Exemplu – Masa unui mol de atomi de neon:
1 mol de atomi de Ne reprezintă cantitatea de Ne care conţine 6.022.x.1023 atomi de Ne şi are valoarea de 20.18g. În calcule, se foloseşte, de obicei, valoarea rotunjită a masei atomice a neonului, 20g. Deci cantitatea de 20g Ne corespunde unui mol de atomi de Ne.