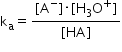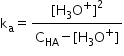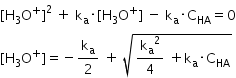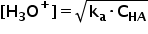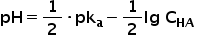pH-ul unei soluții apoase reprezintă cantitatea de protoni (sau ioni hidroniu) care se găsesc în soluție, și este definit prin relația: pH = -lg [H3O+]
Operatorul matematic p poate fi folosit și pentru a exprima alte cantități, spre exemplu:
pka = -lg ka
pOH = -lg [HO-]
pkw = -lg kw
Cu cât pH-ul unei soluții este mai mare, cu atât concentrația molară a ionilor hidroniu este mai scăzută.
La 25° C, în apa pură se găsește următoarea concentrație de ioni hidroniu: [H3O+] = 1,0·10-7 mol/L, echivalentă cu pH = 7.
Soluții neutre: pH = 7
Soluții acide: pH < 7
Soluții bazice: pH > 7
Produsul ionic al apei, kw, face legătura între pH, pOH, [H3O+], și [HO-].
La 25° C, următoarele relații sunt valabile pentru soluțiile apoase de acizi și baze:
kw = [H3O+]·[HO-] = 1,0·10-14 (mol/L)2
pH + pOH = pkw = 14
Acizii monoprotici sunt acizii care conțin un singur atom de hidrogen în structura lor, deci acizii care ionizează într-o singură treaptă. Exemple de acizi monoprotici tari: HCl, HClO4.
pH-ul acizilor tari
Acizii tari disociază complet în soluții apoase: HA(aq) + H2O(l) → A-(aq) + H3O+(aq)
Se consideră CHA ca fiind concentrația molară inițială a acidului tare. În cazul acizilor monoprotici tari: CHA = [H3O+]. Astfel, pH-ul unui acid tare se determină cu relația:
pH = -lg [H3O+] = -lg CHA
pH-ul acizilor slabi
Acizii slabi disociază foarte puțin în soluții apoase, echilibrul fiind deplasat foarte mult spre stânga:
HA(aq) + H2O(l)  A-(aq) + H3O+(aq)
A-(aq) + H3O+(aq)
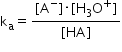
Concentrația molară inițială a acidului HA este CHA.
Se consideră că la echilibru: [H3O+] = [A-] și [HA] = CHA - [H3O+]. Astfel, constanta de aciditate devine:
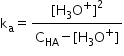
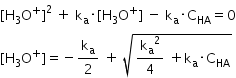
Pentru acizii slabi care au ka < 10-5, termenii (-ka/2) și (ka2/4) se neglijează. Astfel, se obține o relație simplificată pentru calculul concentrației ionilor hidroniu din soluție:
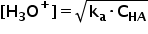
pH-ul acizilor slabi se calculează conform relației:
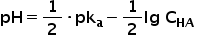

 A-(aq) + H3O+(aq)
A-(aq) + H3O+(aq)