Bazele tari acceptă protoni foarte ușor, și disociază complet în soluții apoase, în ionii componenți.
Baze tari sunt hidroxizii metalelor alcaline (LiOH, NaOH, KOH, RbOH, CsOH) și hidroxizii unor metale alcalino-pământoase (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Ecuația reacției de disociere completă a unei soluții de hidroxid de potasiu (KOH) 0,1 M în apă:
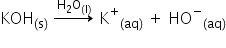
[K+] = 0,1 mol/L
[HO-] = 0,1 mol/L
Bazele slabe nu conțin gruparea hidroxil în structura lor, ele acceptă un proton de la o moleculă de apă, lăsând astfel în urmă un ion hidroxil.
Ecuația reacției unei baze slabe B cu apa:
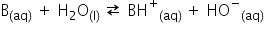
Constanta de bazicitate, kb, care caracterizează echilibrul de mai sus are următoarea expresie:
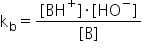
Bazele slabe nu formează foarte mulți ioni la dizolvarea în apă, iar valoarea constantei de bazicitate, kb, este, în general, foarte mică. Astfel, valoarea kb se poate exprima și folosind exponentul de bazicitate, pkb. Exponentul de bazicitate este definit prin următoarea relație: pkb = -lg kb
Cu cât valoarea lui kb es te mai mare, iar valoarea pkb este mai mică, cu atât baza este mai tare.
Baze slabe sunt, de obicei, compușii care au în structura lor un atom de azot cu o pereche de electroni neparticipanți. Amoniacul (NH3), aminele (RNH2), diaminele (R2NH), și triaminele (R3N) sunt baze slabe. Exemple: metilamina, dietilamina, trimetilamina.
Amfionii sau substanțele amfotere sunt substanțele care se comportă ca o bază în reacțiile cu acizi, iar în reacțiile cu baze se comportă ca un acid.
Exemple de substanțe amfotere: apa, ionul sulfură acidă (HS-).
Reacția de autoionizare a apei: 2H2O  HO- + H3O+
HO- + H3O+
Acest echilibru este caracterizat prin produsul ionic al apei, kw care are următoarea expresie:
kw = [HO-]·[ H3O+]
La 25° C produsul ionic al apei are următoarea valoare:
kw =1,0 · 10-14 (mol/L)2 la 25° C
Produsul ionic al apei face legătura între constanta de aciditate a unui acid și constanta de bazicitate a bazei sale conjugate. Deci pentru un cuplu acid-bază conjugată, sunt valabile următoarele relații:
kw = ka · kb
pka + pkb = pkw = 14

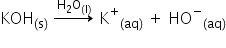
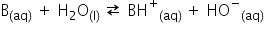
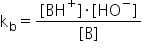
 HO- + H3O+
HO- + H3O+




