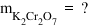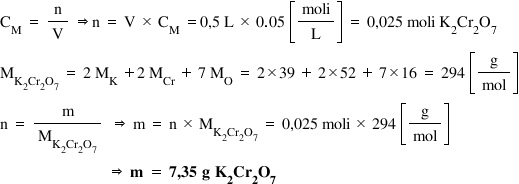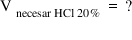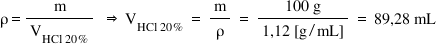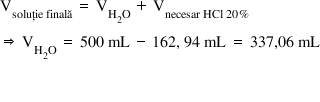Concentraţia molară - aplicaţii
Partajeaza in Google Classroom

Transcript
a rezolvat data trecută câteva
probleme legate de concentrații
procentuale Haideți să facem acum
și câteva exemple de calcul cu
concentrație molară pentru a calcula
concentrația molară a unei soluții
obținute prin dizolvarea a unei
mase de solut între un anume volum
putem fi să aplicăm direct formula
concentrației molare concentrația
molară fiind egală cu numărul de
moli de soluții mult de soluție
în litri e putem să folosim regula
de trei simpla pornind de la definiția
concentrației molare pentru a afla
Câți moli de soluție găsesc pentru
un volum de soluție să zicem că
suntem în laboratorul de chimie
și trebuie să preparăm 500 ml de
soluție de hidroxid de sodiu 0 molar
de care avem nevoie pentru un experiment
în instrucțiunile experimentului
scrie că pentru a această soluție
trebuie să dizolvăm 4 g de hidroxid
de sodiu în apă însă nu suntem
atenți și dizolvăm 6 g de hidroxid
de sodiu ne dăm seama de greșeală
dar experimentul este deja terminal
deci acum Trebuie neapărat să aflăm
ce concentrație molară are De fapt
soluția pe care a folosit o nouă
la desfășurare a experimentului
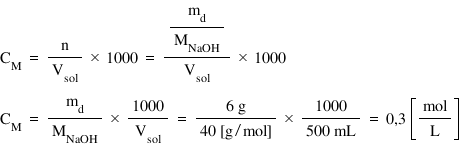
Deci masa de solvat este de 6 g
iar volumul soluției este de 500
ml mai întâi trebuie să calculăm
masa molară a hidroxidului de sodiu
masa molară a hidroxidului de sodiu
fiind egală cu suma maselor molare
ale sodiului oxigenului și hidrogenului
valori pe care le găsim în tabelul
periodic Deci 23 plus 16 plus 1
egal cu 40 de g pe moli putem aplica
a formula de cal cool pentru volumul
în mililitri concentrația molară
este egală cu numărul de moli supra
volum arie știind că numărul de
moli este egal cu masa de soluție
ci cu MD supra masa molară m totul
supra volum 1000 Deci concentrația
molară este egală cu MD supra m
ori 1000 supra volum și locuind
cu valorile 6 supra 40 ori 1000
supra 500 obținem că soluția noastră
are o concentrație de 0 molara sau
am fi putut să transformăm de la
început cei 500 de ml în 0 L ca
să nu ne mai complicăm și astfel
concentrația molară a fost egal
cu MD supra m o r 1 supra z și
bineînțeles că obținem tot o concentrație
de 0 molar și pentru cei cărora
nu le prea plac formulele Aplicând
definiția concentrației molare
putem calcula cu regula de trei
simpla numărul de moli de hidroxid
de sodiu din cele șase grame de
substanță care se află în cei 500
ml de soluție Si apoi îi putem
raporta la un litru adică la 1.000
ml de soluție mai întâi trebuie
să calculăm numărul de moli de
hidroxid de sodiu după cum știm
numărul de moli este egal cu masa
supra masa molară Deci în cazul
nostru avem șase grame supra 40
de g pe Mol adică avem 0 moli de
hidroxid de sodiu știind că 500
de ml de soluție conțin 0 moli de
hidroxid de sodiu și trebuie să
aflăm care este concentrația de
hidroxil dintre 1.000 de ml de
soluție dacă va fi concentrația
molară reprezintă numărul de moli
care se găsesc pentru un litru
de soluție sau 1000 de mililitri
10 mulțimi de diagonalele obținem
următoarea relație matematică 500ml
ori concentrația molară egal cu
1.000 ML o ori 0 moli și din această
relație de ducem că valoarea concentrației
molare este egală cu 1000 ori 0
supra 510 este egală cu 0 pentru
a prepara o soluție de o anumită
concentrație necesară întrun xperiment
avem nevoie de condiții care se
asigură obținerea unui concentrație
doctor pentru aceasta folosind
instrumente de măsură precizie
balanta analitică pentru cântărirea
a Cât mai exact a masei de solutii
balon cotat pentru măsurarea volumului
de soluție pentru a prepara 500
ml de soluție de dicromat de potasiu
de concentrație 0 molari trebuie
să parcurgem mai multe etape mai
întâi calculăm masa de dicromat
de potasiu de care avem nevoie
Din formula concentrației molare
obținem numărul de moli Care este
egal cu volumul lor valoare concentrației
molare adică este egal cu 0 L ori
0 moli pe litru și vedem că avem
0 de dicromat de potasiu după aceasta
trebuie să calculăm masa molară
a diplomatului Care este egală
cu 2 ori masa molară a potasiului
plus doi ori masa molară a cromului
și plus 7 ori masa molară a oxigenului
și făcând calculele cu valorile
pe care le avem în tabelul periodic
obținem că masa molară a diplomatului
de potasiu este egală cu 294 de
g pe Mol acum numărul de moli și
masa molară Deci Putem afla masa
de solut care va fi egală cu produsul
dintre numărul de moli și adică
cu 0 moli ori 294 G pe Mol și astfel
obținem o masă de solut de 7 g dicromat
de potasiu în Următorul pas cântărim
cantitatea obținută la balanța
analitică pe o sticlă de ceas Și
apoi introducem cu grijă substanța
în balonul cotat de 500 ml în pasul
patru adăugăm apă până la aproximativ
jumătate din balon și agităm până
când dicromatul se dizolvă în pasul
5 trebuie să aducem la semn adică
să completăm cu apă până când meniscul
soluției este la semnul de pe balon
Deci când Privim balonul cotat
meniscul trebuie să arate exact
ca în imagine și astfel Am obținut
o soluție de dicromat de potasiu
de exact 0 molari în continuare
Haide să mai vedem încă un exemplu
despre cum putem calcula masa de
soluție de concentrație molară
cunoscută să zicem că am găsit
pe internet un experiment pe care
vrem să le facem și noi în laborator
în experiment se folosesc 500 de
ml de soluție de hidroxid de sodiu
de concentrație 0 molar Ce cantitate
de hidroxid de sodiu trebuie să
folosim pentru a obține și noi
aceeași soluție știm din prima
problemă că masa molară a hidroxidului
de sodiu este egală cu 40 de g
pe Mol se transformă în volumul
din 500 ml în 0 L Aplicând direct
formulele de calcul Aflăm numărul
de moli în acest fel concentrația
molară este egală cu numărul de
moli pe volum Deci numărul de moli
este egal cu produsul dintre concentrație
molară și volum adică cu 0 moli
pe litru orz 0 L și astfel obținem
că numărul de moli este egal cu
0 moli de hidroxid de sodiu cunoaștem
numărul de moli și masa molară
de hidroxid de sodiu Deci masa
de hidroxid de sodiu va fi egală
cu produsul dintre numărul de moli
și masa molară adică va fi egală
cu 0 moli ori patru pe mall și astfel
obținem o masa de 6 g de hidroxid
de sodiu deci acum putem prepara
soluția de care avem nevoie pentru
a efectua experimentul în continuare
vom face și o problemă cu acidul
clorhidric în soluție apoasă cu
o concentrație de aproximativ 20%
este folosit foarte des în analize
cantitative în Laboratoarele de
chimie să vedem de ce volum de
soluție apoasă de acid clorhidric
20% am avea nevoie pentru a prepara
500 de ml de soluție 2 molar deci
cunoaștem concentrația procentuală
Care este 20% mai știm și că densitatea
acidul clorhidric este de 1 g pe
mililitru volumul de soluție de
care avem nevoie este de el iar
concentrația acestei soluții este
2 molar iar pe noi ne interesează
volumul de acid clorhidric 20%
de care avem nevoie pentru a obține
această Luci doimo la pornim de
la soluției de concentrație 2 molari
de care avem nevoie trebuie să
vedem ce masa în grame de acid
clorhidric conține această soluție
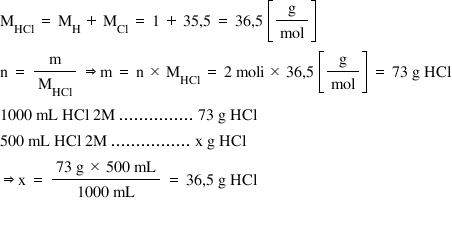
mai întâi calculăm masa molară
a acidului clorhidric Care este
egală cu masa molară a hidrogenului
plus masa molară A clorului deci
cu 36 g pe Mol în soluția noastră
2 molară avem Deci doi moli de
acid clorhidric într un litru de
soluție astfel Cunoscând și masa
molară putem calcula masa de acid
clorhidric care se găsește un litru
de soluție 2 molar prin produsul
dintre numărul de moli și masa
molară și obține încă doi ori 36
este egal cu 73 de g de acid clorhidric
din definiția concentrației molare
putem calcula masa m de acid clorhidric
gazos de care avem noi nevoie pentru
cei 500 ml de soluție pentru litru
de soluție 2 molară adică 1.000
de ml avem cu după cum am calculat
mai devreme 73 de g de acid clorhidric
de 500 ml de soluție 2 molar vom
avea o masă m Care este egală cu
73 de grade ori 500 ml totul supra
1.000 ML Deci cu 36 g de acid clorhidric
pentru a afla volumul de soluție
de acid clorhidric 20% de care
avem noi nevoie Trebuie mai întâi
să aflăm volumul de soluție de
acid clorhidric 20% care corespunde
unei mase de 100 de g înalte cuvinte
conform definiție concentrație
procentuală avem 20 de g de acid
clorhidric în 100 de g de soluție
dar pe noi ne interesează ce volum
ocupa aceste 100 de g de soluție
Iar asta Putem afla folosind unei
bineînțeles de densitate de aici
putem scoate relația pentru volum
adică volumul va fi egal cu masa
de soluție de acid clorhidric supra
valoarea densității acidului clorhidric
adică cu 100 de g supra 1 grame
pe mililitru și obținem astfel
că 100 de g de acid clorhidric
ocupă un volum de 89 virgulă 28ml
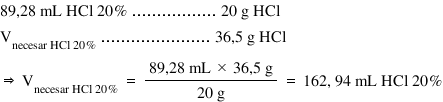
Așadar conform definiției concentrației
procentuale în aceștia 89 virgulă
28.000 ml de soluție Dar ce clorhidric
20% avem 20 de g de acid clorhidric
gazos iar volumul de care avem
noi nevoie conține 36 g de acid
clorhidric și aplică regula de
trei simple obținem că volumul
nostru este egal cu 89 virgulă
28 ML ori 36 G totul supra 20 de
g Ce este egal cu 162 virgulă 93
ml soluție de acid clorhidric 20%
Deci dacă adăugăm în apă acest
volum de acid clorhidric 20% până
la 500 de ml vom obține soluția
de acid clorhidric 2m Olari de
care aveam nevoie dacă ne avem
întru laborator și trebuie să preparăm
îți astăzi Soluție Nu procedăm
ca în cazul obținerii soluției
de dicromat de potasiu în sensul
că în niciun caz nu punem acidul
un balon cotat după care să adăugăm
apă peste el pentru al aduce la
semn rețineți că niciodată nu adăugăm
apă peste acid și numai invers
adăugăm acid peste apă dar treptat
prin picurare asta deoarece între
A5 și apă are loc o reacție exotermă
Adică o reacție prin care se generează
căldură Dacă adăugăm apă oricât
de puțină peste o cantitate mare
de acid are loc o reacție violentă
și în ea putea răni pe noi sau
pe colegii din jurul nostru când
adăugăm cantități mici de acid
între o cantitate mai mare de apă
apa va avea timp să medieze căldura
generată de reacția cu acidul până
când noi adăugăm următoarele picături
de acid Deci pentru a ne proteja
la prepararea unei astfel de soluții
calculăm exact volumul de apă de
care avem nevoie pentru volumul
de soluție dorit Și peste acest
volum de apă adăugând treptat în
cantități mici volumul de acid
în ultimele două videouri am văzut
că problemele de concentrații sunt
logice iar formulele sunt ușor
de aplicat odată ce am înțeles
ce reprezintă concentrația molară
și concentrația procentuală