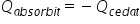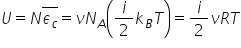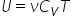Ecuaţia calorimetrică. Energia internă.
Tag-uri
Partajeaza in Google Classroom

Transcript
încet dar noua lecții de termodinamică
vom discuta despre următoarele
noțiuni de calorimetrie ecuația
calorii metrică și energia internă
calorimetrul este un dispozitiv
folosit pentru măsurarea schimbului
de căldură dintre un corp și un
mediu cu proprietăți cunoscute
în cele mai multe cazuri apă întreg
sistemul este izolat de un înveliș
adiabatic adică un înveliș care
nu permite schimbul de căldură
cu mediul extern cantitatea sau
mărimea cel mai des măsurată de
către un calorimetru este căldura
specifică a corpului studiat există
două tipuri de calorimetre în funcție
de tipul de schimb de căldură Ce
are loc între corp și mediul din
calorimetru cel mai cunoscut este
calorimetrul bertlo în care schimbul
de căldură are loc cu variația
de temperatură în interiorul sistemului
noi până acum am definit doar un
schimb de căldură Ce are loc cu
variații de temperatură Deci ați
putea spune că acesta putea fi
singurul fel de calorii metru totuși
există un schimb de căldură Ce
are loc fără variație de temperatură
despre care vom vorbi în întruna
din lecțiile viitoare de termodinamică
și anume schimbul de căldură Ce
are loc la schimbarea stării de
agregare Spre exemplu la evaporarea
unui lichid evaporarea apei are
loc fără va de temperatură dar
cu schimb de căldură pentru studierea
acestui tip de tip de căldură se
folosește așa numitul calorimetru
izoterm care Deci studiază schimbul
de căldură ce apare la schimbarea
stării de agregare și fără variație
de temperatură un calorimetru Folosește
două noțiuni fundamentale ale termodinamicii
prima este așa numitul principiul
0 al termodinamicii despre care
discuta în cea de a doua lecție
de termodinamică când am definit
temperatura și scările de temperatură
principiul 0 al termodinamicii
Stabilește proprietatea de tranzitivitate
echilibrului termic între mai multe
sisteme termodinamice și este necesar
de fiecare dată când măsurăm o
temperatură folosește de asemeni
așa numita ecuație calorimetrica
care spune foarte simplu că pentru
un calorimetru Care este un sistem
izolat de învelișul adiabatic Deci
nu face schimb de căldură cu exteriorul
căldura primită este egal cu minus
căldura cedată bineînțeles ne referim
la schimbul de căldură din interiorul
calorimetrului Haideți să vedem
cum se aplică în practică acest
folosirea acestui calorimetru și
a ecuației calorimetrice pentru
măsurarea călduri specifice a unui
corp Deci ceea ce vedeți în această
imagine este un dispozitiv tipic
de tip calorimetric și anume avem
un înveliș adiabatic format dintr
un strat dublu în interiorul căruia
se află aer la densitate foarte
mică ceva ce aproximează vidul
De ce are o tranzitivitate o capacitate
de a transmite temperatura foarte
mică suporții au această formă
tocmai pentru a minimiza suprafața
de contact dintre interior și exterior
Deci aceasta formează un înveliș
adiabatic în care schimbul de căldură
cu mediul exterior este 0 în interiorul
calorimetrului Avem apă purificată
și corpul a cărui proprietăți dorim
să le studiem de asemeni avem un
termometru pentru măsurarea temperaturii
sau un caz mai general mai multe
termometre pentru măsurarea temperaturilor
și Deci dorim să folosim acest
calorimetru Pentru a măsura căldura
specifică ce ce a corpului notat
cu ce cunoaștem masă corpului masa
apei și căldura specifică a apei
și capacitatea calorică k a dispozitivului
calorimetric măsurăm de asemeni
temperaturile inițiale ale corpului
și a apei pe touch ieșite Da am
și temperatura finală a întregului
sistem după ce echilibrul termic
sa stabilit în interiorul calorimetrului
Bineînțeles că dacă Reprezentăm
grafic temperatura care se măsoară
în grade Celsius ca funcție de
timp care se măsoară în secunde
vom porni de la anumită temperatură
a apei și o temperatură mai mare
te taie si a corpului și ce vom
observa este că Pe măsură ce echilibrul
termic dintre ele se obține ele
vor evolua Bineînțeles către o
temperatură comună mici obținem
o stare de echilibru termic la
după un anumit timp mergi după
un anumit timp se obține starea
de echilibru termic dintre corpurile
calorimetrului această temperatură
1 dăm cu teta fina De ce aceasta
este temperatura finală de echilibru
termic dintre corp și apă prin
apă înțelegem atât apa cât și cuva
adică dispozitivul calorimetric
în care a pus ea în timpul stabilirii
acestui echilibru termic corpul
va ceda căldură Deci vom avea o
căldură cedată care va fi primită
de către calorimetru adică apă
și cupru avea un Q primit căldură
primită ecuațiile pentru cele două
călduri sunt următoare căldura
cedată de corp va fi egală cu masa
corpului înmulțită Cu căldura specifică
a corpului înmulțită cu variația
de temperatură aceste definițiile
am dat în lecția precedentă această
ecuație venind din ecuația de definiție
a căldurii specifice de asemeni
pentru căldura primită de către
apă putem scrie ecuația următoare
căldura primită este egală cu masa
apei muncită Cu căldura specifică
a apei plus capacitatea calorică
a calorimetrului Deci prin apă
repet înțelegem atât apa cât și
cuva care o conține Deci k este
capacitatea calorică a acestui
disco Cities înmulțită cu variația
de temperatură a apei temperatura
finală a minus temperatura apei
și bineînțeles după cum am spus
folosim ecuația calorimetrica care
spune că căldura primită este egală
cu minus căldura cedată combinând
acestei ecuații putem scrie că
căldura specifică a corpului va
fi egală cu masa apei muncitor
căldura specifică a apei plus capacitatea
calorică a calorimetrului înmulțită
cu variația de temperatură a apei
împărțită la masa corpului și în
care este multă cu teta c temperatura
inițială a corpului minus temperatura
finală asta datorită semnului mini
observăm că toate mărimile din
această ecuație sunt pozitive tot
is minus teta apă este pozitiv
Deta c minus teta final Este pozitiv
Deci asta este felul în care se
folosește un calorimetru Pentru
a măsura căldura specifică a unui
corp oarecare să trecem la o nouă
noțiune cea de energie internă
energia internă se notează cu u
și este energia unui sistem termodinamic
ce se datorează mișcării și interacțiunii
atomilor sau moleculelor din interiorul
sau dacă considerăm un sistem termodinamic
are care avem două tipuri de energii
avem energii externe care sunt
de tip mecanic și le am studiat
în legile de conservare a energiei
și impulsului din mecanică ele
sunt una dată de mișcarea corpului
sau sistemului termodinamic an
întreg și eventual interacțiune
a sistemului nostru termodinamic
cu un alt sistem aceste energii
externe ale corpului de tip mecanic
sistemul are de asemeni și energii
interne aceasta Acestea se datorează
interacțiunilor dintre moleculele
sau atomii sistemului și mișcării
acestor molecule sau atomi Deci
când spunem energie internă referim
la energia din interior nu și la
energia din exterior cu care pe
care o are corpul ca un întreg
sau sistemul ca un întreg în cazul
unui gaz ce se nu se află la presiune
înaltă știm din lecțiile de teorie
cinetică moleculară că putem aplica
modelul gazului ideal Deci modelul
gazului de el după cum am stabilit
în acele lecții nu se poate aplica
lichidelor și solidelor sau gazelor
aflate la Sulina altfel gazele
la presiuni joase sau normale sunt
bine descrise de către acest model
cine acest caz putem neglija interacțiunile
dintre atomi și molecule și energia
internă va fi dată numai de mișcarea
lor iar această mișcare este deschisă
de energia cinetică medie Deci
energia internă a unui gaz ideal
va fi prin definiție egală cu numărul
de atomi sau molecule înmulțită
cu energia cinetică medie a unui
atom sau a unei molecule ecuația
pentru această energie cinetică
medie a fost dată în prima lecție
de teorie cinetică moleculară și
este aceasta deci putem scrie pentru
energia internă că este egală cu
numărul de moli înmulțită cu numărul
lui avogadro de aceasta vine din
definiția numărului avogadro Care
este numărul de atomi sau molecule
permis Deci numărul total va fi
numărul de moli înmulțit cu numărul
lui avogadro înmulțită cu ecuația
pentru cinetică medie care este
aceasta numărul de grade de libertate
înmulțit împărțit la 2 înmulțesc
Constanța lui boltzmann și te piși
temperatura din nou ecuația este
dată în prima lecție de teorie
cinetico molecular datorită faptului
că Constanța boltzmann este definită
ca raportul dintre Constanta mire
sau Constanța universală a gazelor
și numărul avogadro putem R scrie
ecuația pentru energie internă
în felul următor În fine ecuația
finală a energiei interne va fi
numărul de înmulțit cu cvt relația
folosită în particulară aceea Că
căldura specifică molară la volum
constant CV este egal cu numărul
de grade de libertate împărțit
la 2 înmulțit cu Constanța mire
va fi demonstrat în lecția viitoare
Deci această ecuație care a fost
folosită în pasul final al derivării
cu ei pentru energia internă va
fi demonstrată în lecția viitoare
împreună cu ecuația mai generală
numită ecuația mire și anume că
CP egal cu c v plus Deci pentru
aceste demonstrație lecția viitoare
o concluzie din această definiție
și Ecuația acompaniată a pentru
gaze deal este că energia internă
este un parametru de stare intensiv
reamintesc parametru de stare înseamnă
că ia o valoare dată pentru o stare
dată deci energia internă va avea
o valoare pentru o stare sau moment
dat în particular dacă avem un
proces termodinamic între două
stări termodinamice a și b energia
o va lua o valoare pentru fiecare
stare finală inițială sau intermediară
ea nu e o valoare pentru întreg
procesul si pentru fiecare stare
de a lungul procesului intensiv
înseamnă că nu depinde de volumul
sistemului ceea ce vedem direct
din ecuația pentru iarăși specifică
în această proprietate depinde
doar de temperatura sistemului
nu și de Volumul lui am demonstrat
acest lucru pe bază de origine
Tico moleculare Acest lucru se
demonstrează și experimental prin
așa numitul experiment jur de ce
experimentul experimentul Joule
Demonstrează că nu depinde de vie
și în fine pentru un sistem închis
și izolat energie internă este
constant sistemul închis înseamnă
un sistem în care masă sau dacă
vreți numărul de moli sunt constante
iar sistem izolat înseamnă cel
care nu schimbăm căldură sau dacă
vrei să te împărat ură cu mediul
extern din ecuația pentru energia
internă observăm că dacă atât nu
cât și te sunt constante atunci
Bineînțeles că este o constantă