Experimentul Rutherford. Modelul planetar al atomului.
Tag-uri
Partajeaza in Google Classroom

Transcript
În ce dat doua lecții de fizică
atomică vom discuta despre experimentul
rutherford și despre modelul planetar
al atomului Ce rezultă din acest
experiment Russell for ce a propus
studierea structurii interne atomilor
prin împrăștierea unui fascicul
de particule încărcate electric
pe aceștia atomi și măsurare a
Proprietăților acestor particule
după împrăștiere adică după interacția
cu apă înainte de a trece la dispozitivul
experimental să subliniez un fapt
și anume că bineînțeles până la
rață Ford nu se știa nimic despre
structura internatul nu se știa
doar că acești atomi există în
concluzie ar fi folositor dacă
și dumneavoastră ați face abstracție
de tot ceea ce știți deja despre
structura atomilor pentru a înțelege
modul în care rutter forte procedat
Deci să discutăm dispozitivul a
experimenta primul lucru de care
avea nevoie rutherford era acest
fascicul de particule încărcate
la folosit o sursă de particule
Alfa care sunt nuclee de heliu
Ciao sarcină electrică plus doi
plus doi suc două sarcini electrice
elementare de ce a folosit ca sursă
radio Radio activ acest atom sau
ces nucleu este instabil și se
dezintegrează după un anumit timp
producând aceste fascicule de particule
Alfa care au viteză mare aproximativ
viteza medie este aproximativ 1
ori 10 la 7 metri pe secundă Care
este aproximativ 5% din viteza
lumii apoi bineînțeles a doua parte
a experimentului sunt atom Adică
o substanță are nevoie de substanță
către care se îndrepta acest fascicul
de particule era folosit de cica
țintă a fasciculului de particule
o foiță de aur foarte subțire 5
ori 10 la minus 7 m sau dacă doriți
0 micrometri Deci pentru a am Desenați
schematic Razer phone avut o sursă
formată din atomi de radio Radio
activ pe care a închis o incintă
din Plumb cumicu mic orificiu a
folosit Plumb pentru că plumbul
este foarte eficient în a ecran
a opri aceste particule Alfa bineînțeles
a lăsat un orificiu pentru a produce
acest fascicul Deci prin orificiu
au obținut fascicolul de particule
Alfa Nici acesta este schematic
reprezentat fascicolul de particule
Alfa care sunt după cum am spus
nuclee de heliu care are sarcină
plus 2 acest fascicul intersecta
o foiță de aur foarte subțire și
în felul acesta interacționa cu
atomii din din interior și era
împrăștiat pe el Pentru a măsura
acest aceste particule Alfa împrăștiate
rosser Ford și colaboratorii săi
a folosit un detector de particule
Alfa Deci un o a treia componentă
a experimentului este un ecran
fluorescent care înconjoară complet
ținta exceptând un orificiu prin
care intră fasciculul de particule
în care măsura particule Alfa împrăștiate
pe foiță de Aur și în fine întregul
dispozitiv experimental se afla
întru incintă vidată Pentru a evita
interacția dintre fascicolul de
particule Alfa și atomii din aer
care ar fi produs un semnal nedorit
rezultatele acestui experiment
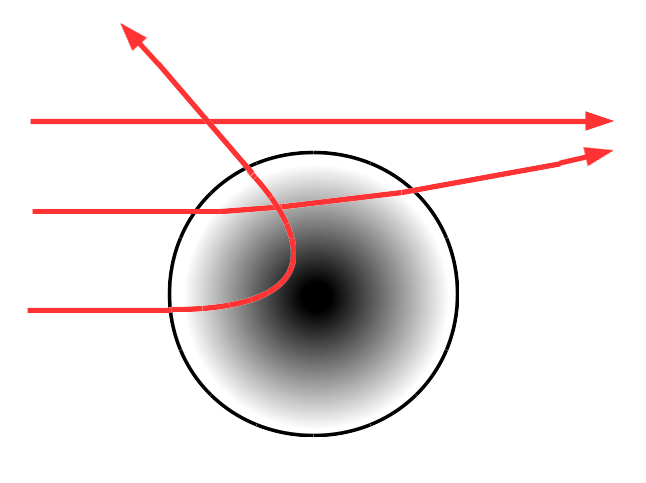
În primul rând sau observat că
aproape toate dar nu chiar toate
particule Alfa traversează foița
fără de vie asta înseamnă că aproape
toate particulele Alpha împrăștiate
ajung în ecranul Florești Cent
în Prelungirea razei incidente
fără devieri al doilea rezultat
există totuși o foarte mică fracție
1 o particulă Alfa din 10.000 totuși
suferă împrăștiere asta înseamnă
că în ecranul Florești Sant este
detectată la un unghi să îl numim
teta mai mare decât z al treilea
rezultat este că dintre aceste
particule puține care suferă împrăștie
o mare fracție sunt împrăștiate
la 180 de g deci dintre particulele
care au tata mai mare decât 0 o
mare parte au teta foarte aproape
de 180 de grade sunt împrăștiate
în direcția opusă fasciculul incident
și în fine al patrulea rezultat
este că această fracție a particulelor
împrăștiate meci această fracție
crește cu grosimea foiței Deci
dacă foița grosimea foliei este
crescută atunci din ce în ce mai
multe particule au tata mai mare
decât 0 și de asemeni dacă înlocuim
foița de aur cu foițe din alte
metale care au masa atomică mai
mare atunci de asemeni această
fracție crește Haideți să discutăm
acum despre concluziile ce pot
fi trase din aceste patru rezultate
experimentale În primul rând din
primele două rezultate experimentale
și din faptul pe care îl voi explica
imediat că foița are sute are multe
straturi de atomi de ordinul sutelor
rezultă că atomii constau sau sunt
formați în cea mai mare parte din
spațiu gol Haideți să explicăm
un pic de unde a rezultat chest
lucru în primul rând să îmi socotim
aproximativ să calculăm aproximativ
numărul de straturi de atomi din
foiță Deci dacă luăm densitatea
aurului ca fiind egală cu 2 ori
10 la a patra kilograme pe metru
cub și apoi masa unui atom de aur
Care este bineînțeles prin definiție
a valoarea masei atomice înmulțită
cu masa unei unități atomice de
masă Deci aproximativ egală cu
3 ori 10 la Minus 25 kg din aceste
două valori putem calcula imediat
volumul unui volumul mediu al unui
atom de aur ca fiind rămas împărțit
la de la densitate și Deci egal
cu 1 ori 10 la minus 9 29 metri
cubi acesta ar fi volumul mediu
pe care un atom Indiferent De ce
înseamnă acest atom de aur de la
acest ar trebui să fie Volumul
lui mediu de aici putem calcula
imediat raza medie a unui atom
deoarece volumul este 4 pe 3 ARCUB
De ce aproximam atomul ca având
două formă sferică și atunci volumul
unei sfere este legat de raza lui
prin aceasta formula geometrică
și Deci obținem că raza medie a
unui atom de aur a trebui să fie
în jur de 1 ori 10 la minus 10 metri
bineînțeles în acest calcul suntem
interesați doar în valorile aproximative
pentru a calcula un număr aproximativ
de straturi de atomi și acum suntem
gata să facem acest calcul deoarece
știind că grosimea foiței de aur
în experimentul lui rutherford
după cum am spus era 5 ori 10 la
minus 7 metri și Deci distante
straturi de atom ar trebui să fie
egal cu grosimea foiței împărțită
la dimensiunea unui atom Sau dacă
vreți la diametrului care ar fi
de două ori raza Deci numărul aproximativ
de straturi de atomi din foiță
a lui rutherford ar trebui să fie
5 ori 10 la minus 7 împărțit la
3 ori 10 la minus 10 făcând acest
calcul rezultă că ar trebui să
fie undeva la 1.560 de strat de
atomi bineînțeles acesta nu este
un număr fix un număr un calcul
precizăm dar ne dă un ordin de
mărime al numărului de straturi
de atomi prin care fascicul de
particule Alfa trebuie să treacă
de situație în felul următor avem
un fascicul de particule Alfa cu
sarcină plus doi e care intră întrun
material o foiță de aur care are
stratul de atom Nu știm ce sunt
aceștia toamnă dar știm că numărul
de straturi este foarte mare 1500
Roxy nativ de astfel de straturi
apoi dacă ne gândim la primele
două rezultate experimentale și
anume că aproape toate particule
Alfa cu sarcină electrică trec
prin 1.500 de straturi fără să
li se întâmple nimic singura concluzie
pe care o putem trage este că aceștia
atomi ce formează aceste straturi
sunt în cea mai mare parte spațiu
gol numai în felul acesta particule
Alfa ar putea trece aproape toate
ne deviat a Deci o astfel de linie
care un strat de atomi este de
fapt în cea mai mare parte goală
numai din punct în punct din loc
în loc apărând câte un câte o sarcină
electrică care să interacționeze
cu particular si alti mele două
concluzii trei și patru ne spun
că în centrul atomului se concentrează
toată Masa lui Care E încărcată
cu o sarcină pozitivă proporțională
cu masa atomică de ce putem trage
această concluzie Haideți să desenăm
schema Deci ceea ce se întâmplă
este că o particulă Alfa care are
sarcină plus 2 m în cea mai mare
parte a timpului trece andyvia
99 din aceste particule Alfa trec
ne deviat totuși la un moment dat
o mică fracție din ele încep să
simtă interacția asta înseamnă
că foarte încruntat de atomi de
acesta este un strat în foarte
rar va apărea o sarcină electrică
Deci la un moment dat va apărea
o sarcină electrică mare o notăm
sarcină electrică cu Zet dată apare
această sarcină electrică și particule
Alfa sunt împrăștiate meci aceasta
este altă particulă Alfa dar această
sarcină trebuie să densitatea acestora
sarcini trebuie să fie foarte mică
între o stradă atomi pentru că
99 nu simt nimic de asemeni există
o fracție și aceasta e rezultat
foarte important de particule Alfa
care se ciocnesc ca de un perete
la un moment dat de se întorc la
180 de grade acesta este rezultatul
3 rezultatul 3 ne spune că există
o fracție foarte mică de particule
Alfa care se întorc înapoi Asta
înseamnă două locuri că în momentul
în care le întâlnesc totuși această
sarcină electrică a atomului Ea
este concentrată este punctiformă
este masivă și este pozitivă De
ce este pozitivă pentru că pentru
se întoarce o sarcină pozitivă
trebuie să întâlnească totul sarcină
pozitivă și este masivă pentru
că pentru că atomii structura foițe
de aur rămâne în mare nemodificată
Dacă masa sarcinii atomului cu
care particula Alfa interacționează
ar fi comparabilă cu cea particule
Alfa atunci particula Alfa a disloca
De ce trebuie să fie această sarcină
trebuie să fie punctiformă pozitivă
mare în valoare ca sarcină și de
asemeni mare ca și masă de aici
Russell a lui în legătură cu Cum
trebuie să arate structura internă
a formulat așa numitul model planetar
al atomului în care a sesizat o
similaritate foarte mare între
structura atomului și structura
sistemului solar mai exact a tras
concluzia că în ce atomului trebuie
să se afle o particulă un corp
punctiform foarte mic dar cu masă
și sarcina mare numită numit nucleu
pe care îl aluminiu Clau Deci în
centrul atomului se află un nucleu
care concentrează aproape toată
masa atomului are dimensiuni mult
mai mici decât atomul și este încărcat
cu o sarcină pozitivă care crește
cu masa atomului acesta este al
patrulea rezultate experimental
unde am văzut că numărul de particule
Alfa întoarse înapoi la 180 de
grade crește Pe măsură ce foițele
de metal conțin atom cu masa mai
mare Deci prima concluzie este
rezultă din faptul că 99% dintre
particule trec ne deviat A deci
aceasta acest nucleu Care este
singurul capabil să interacționeze
cu particule Alfa trebuie să fie
foarte mic în centrul atomului
de asemeni dai tot de aici în acest
raționament rezultă că misiunile
acestui atom trebuie să fie foarte
mici un atom este în principal
gol nucleul fiind foarte mic în
centrul lui și de asemenea trebuie
să aibă o sarcină pozitivă pentru
a putea întoarce particular fac
dacă ar avea sarcina negativă Din
contră dar accelera nu le arunc
torci în sens opus de asemeni se
știa că atomi conțin electroni
și Deci electroni se comporte în
atom ca și planetele sistemului
solar adică au masa neglijabilă
au masa foarte mic în comparație
cu masa atomului aceasta este complementarul
concluzie 1 despre nucleu Sunt
încărcați cu o sarcină negativă
aceasta se știa de așa despre electronica
o sarcină negativă și că numărul
lor trebuie să fie egal cu sarcină
nucleului aceasta deoarece atomul
nud Deci pentru a obține o sarcină
totală zero trebuie și deoarece
electronii au sarcină minus 1 atunci
numărul lor trebuie să fie egală
cu sarcina nucleului Care este
unul singur și în fine acest sistem
Atomic este ținut menținut între
o stare de echilibru prin faptul
că forța electrostatica de atracție
dintre nucleul pozitiv și electroni
negativ se comportă ca o forță
gravitațională adică este egală
cu forța centrifugă Deci avem o
atracție electrostatică centripetă
între electroni și nucleu și deoarece
electroni se află pe o traiectorie
circulară în jurul nucleului vom
avea o repulsie centrifugă orice
orice corp care se află în mișcare
circulară este supus unei forțe
centri de ala cu m de pătrat pe
r egalitatea dintre aceste două
forțe ducând la stabilitatea traiectoriei
electronului acest model planetară
la turnului deși a fost un pas
foarte mare în înțelegerea structurii
atomului și un succes experimentul
rutherford a fost un succes al
fizicii fă fiind un pas important
și Major în înțelegerea structurii
atomului totuși El avea o problemă
fundamentală pe care o voi menționa
imediat peste care nu se putea
trece și care spunea că el este
în cel mai bun caz incomplet model
acest model atom această problemă
majoră provenea din electromagnetism
deoarece acesta cere ca electronii
să emită continuu unde electromagnetice
cu aceeași frecvență ca cea de
rotație Deci electromagnetismul
spune că o sarcină electrică care
se află în mișcare pe o traiectorie
curbilinie de are o accelerație
emite radiații magnetică Deci pierde
energie Aceasta este o problemă
fundamentală pentru că înseamnă
că conform electromagnetismului
1 electronii ar trebui să piardă
continuă energie pentru că ar trebui
să radieze această radiații Ektro
magnetice De ce in final electronic
modelului laser force pentru atom
ar trebui să cadă pe nucleu Deci
acest model al atomilor este instabil
atomi sunt instabile electronii
emit trebuie să imite energie Deci
trebuie să piardă energie Deci
trebuie să cadă pe nucleu cercei
știm Bineînțeles că nu se întâmplă
semne după cum am vorbit în lecția
trecută știind că spectre atomice
sunt discrete avem linii și benzi
pe când radiații electromagnetice
emise de aceștia lac tronic conform
teorie electromagnetismului clasic
este continuă Deci modelul planetar
al atomului retur Ford prezice
că spectre atomice sunt toate continentele
pe când experimentul arată că ele
de fapt sunt discrete Deci modelul
rutherford A fost în concluzie
un pas Major în direcția înțelegerii
structurii atomilor dar e este
incomplet pentru că de fapt combinat
cu teoria electromagnetismului
aplicată electroni mișcări electronilor
duce la concluzii care știind că
sunt greșite