Fenolii
Tag-uri
Partajeaza in Google Classroom

Transcript
există două clase importante de
compus hidroxilici alcoolii despre
care am vorbit lecțiile trecute
și stai norii a reprezintă un radical
alchil iar aer reprezintă 1 Cleopa
Roman în continuare vom discuta
despre fenoli a doua clasă de compuși
toxici pe 9 RON sunt compuși Trucks
Ilie ce conțin grupa hidroxil legată
de un atom de carbon hibridizat
sp2 pentru nucleu aromat de numărul
grupelor hidroxil din moleculă
fenoli se clasifică în fenoli monohidroxilici
si care au în moleculă o singură
grupari hidroxil și fenoli polihidroxilici
si care au în moleculă două sau
mai multe grupe hidroxil pentru
a denumi fenoli sunt acceptate
mai multe variante conform iupac
pana Naste din lume și prin adăugarea
sufixului la numele arenei corespunzătoare
în același timp se Indică poziția
grupelor hidroxil în molecular
na dar și prefixul care indică
numărul grupelor hidroxil acolo
unde este cazul tot conform iupac
mai putem denumi fenolii și utilizând
prefixul hidroxi plus denumire
a arenei specificând ca și în cazul
precedent indicii grupelor hidroxil
și prefixul pentru numărul grupelor
hidroxil de asemenea finul iau
și denumiri uzuale astfel denumirile
pentru cele patru exemple de fenoli
din tabel sunt următoarele conform
iupac avem benzenul sau hidroxibenzen
2 metilfenol sau doi Roxy toluene
1 naftalenol sau 1 hidroxi naftalină
și unul patru benzi indian sau
unul patru dihidroxibenzen iar
denumirile uzuale ale compușilor
sunt după cum urmează pe noul orto
crezul Alfa naftol respectiv hidrochinonă
în ceea ce privește proprietățile
fenolilor acestea sunt influențate
de elementele de structură ale
moleculei ca și în cazul alcoolilor
oxigenul din grupa hidroxil la
fenolilor este hibridizat sp3 informează
o legătură Sigma se petrece pe
2 cu un atom de carbon hibridizat
sp2 din nucleul aromatic și o legătură
Sigma sp3s cu atomul de hidrogen
de oxigen din grupa hidroxil mai
are și doi orbitali spre Trei dielectronici
unul din aceeași orbitali orientat
paralel cu orbitalul pe de la de
carbon sp2 de care se leagă oxigenul
și se întrepătrundă lateral cu
el în acest fel orbitalul pai extins
din nucleul aromatic se prelungește
spre atomul de oxigen iar perechea
de electroni din acest orbitale
spectre al oxigenului se deplasează
spre nucleul aromatic astfel se
micșorează densitatea de electroni
de la atomul de oxigen care capătă
o sarcină pozitivă și se mărește
densitatea de electroni în orbitalul
pics teens din nucleul aromatic
În consecință legătura carbon oxigen
din fenoli este parțial dublă Ce
este mai puternică decât legătura
carbonul ce gen din alcool în schimb
atomul de oxigen pozitivat devine
măturător de electroni și polarizează
mai multe legătura oxigenul trojan
adică electronii din legătura covalentă
oxigen hidrogen sunt atragi și
mai mulți domnul de oxigen astfel
legătură oxigen hidrogen din spinone
e mai slabă decât legătura oxigenul
hidrogenul alcool și fenoli sunt
acizi mai tari decât alcoolii poate
cuvinte fenoli cedează mai rapid
Proton la fel ca în cazul alcoolilor
între grupele hidroxil din fenoli
se potrivea Liza a legături de
hidrogen acestea pot fi legături
de hidrogen intermoleculare sau
intramoleculare dacă există mai
multe grupe hidroxil în molecula
fenolul Așadar moleculele fenolilor
sunt asociate între ele prin legături
de hidrogen bineînțeles astfel
de interacțiuni se pot realiza
și între grupele hidroxil din fenoli
și moleculele de apă sau moleculele
de alcooli și fenoli sunt substanțe
solubile în apă în alcool și în
eter monohidroxilici sunt putin
solubil în apă însă solubilitatea
crește Pe măsură ce crește și numărul
de grupe hidroxil din moleculă
la temperatura obișnuită fenolii
sunt substanțe solide iar punctele
lor de topire cresc atunci când
între moleculele lor se pot forma
mai multe legături de hidrogen
proprietățile chimice ale fenolilor
sunt diferite de cele ale alcoolilor
am văzut mai devreme că deplasările
de electroni din moleculele fenolilor
modifică întărirea legăturilor
carbon oxigen și oxigen hidrogen
lucru care în consecință modifică
și reactivitatea grupei hidroxi
un alt Factor care conduce la reactivitate
chimică diferită față de alcooli
faptul că în moleculele fenolilor
grupele hidroxil sunt legate de
nuclei aromatice aromatice având
bineînțeles proprietăți diferite
de radicalii hidrocarburilor alifatice
din moleculele alcoolilor vedem
că două grupe distincte din structura
fenolilor nucleul aromatic și Gruparea
hidroxil se influenteaza Reciproc
sau care determină comportarea
chimică a acestei clase de compuși
Așadar fenoli participat la reacții
chimice specifice grupei hidroxilarea
specifice nucleului aromatică și
în cazul alcoolilor grupa hidroxil
este responsabilă de caracterul
acid al fenolilor după cum ai zis
legătura covalentă dintre oxigen
și hidrogen este polară astfel
că pe noi pot ceda produsă în cazul
fenolilor această legătură e mai
slabă decât legătură oxigen hidrogen
din alcool sau chiar și decât legătură
oxigen hidrogen din apă asta face
ca fenolii să cedeze Proton mai
ușor decât alcoolii sau apa 12
9 și sunt acizi relativ slab sunt
acizi mai tari decât alcoolii și
decât apa În consecință fenolici
manifestă caracterul acid numai
în reacțiile cu Metalele alcaline
cazul alcoolilor și al apei și
și în reacțiile cu hidroxizii alcalini
din ambele tipuri de reacții se
obțin pe nu luați sau fenoxizii
alcalin în cazul exemplu noastre
fiind vorba de fenolatul de sodiu
un exemplu este reacția dintre
Alfa naftol și structuri de sodiu
reacția prin care obtinem Alfa
natura de sodiu și apă în ceea
ce privește nucleele aromatice
din fenoli atâtea participă la
reacții de substituție specifice
arenelor precum reacțiile de halogenare
de alchilare de nitrare sau de
sulfonare să ne reamintim din lecțiile
dedicate că grupa funcțională hidroxil
este un substitut de ordinul 1
asta înseamnă că activează nucleul
aromatic în reacțiile de substituție
și orientează substituitii în pozițiile
orto și para față de Gruparea hidroxil
astfel reacțiile de substituție
la care participă fenolii au loc
în condiții mai blânde decât reacțiile
de substituție ale arenelor corespunzătoare
și în plus sunt și orientate Spre
exemplu reacția de nitrare a fenolului
are loc în prezență de vot din
luat la temperatura obișnuită și
conducerea la un amestec de aur
Toni Trofin All și para nitrofenol
cu acid azotic mai concentrat tema
puține 2 4 dinitrofenol și 246
trinitrofenol o altă reacțiile
importantă de substituție este
reactia de sulfonare prin tratarea
fenolului cu acid sulfuric concentrat
la temperaturi mai mici de 100
de grade Celsius obținem în amestec
de acid ortofosforic și acid para
finul sulfonic și la fel ca în
cazul intrării și sub formarea
în condiții mai energice conduce
la acidul 2 4 fenoli disulfonic
sau la zidul 246 fenol trifon fenolii
au multipli aplicații în industrie
exemplu sunt utilizați în industria
coloranților în sinteza medicamentelor
a unor soluții antiseptice dar
și a materialelor plastice fenolului
100 caustică extrem de toxic dacă
este ingerat iar pe piele produce
arsuri în natură întâlnim fenoli
în diferiți compuși din plante
plecăm în lignina din lemn în uleiul
de cimbru și de kimyon când au
acțiune antiseptică

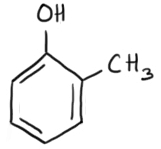 2-metilfenol sau 2-hidroxitoluen
2-metilfenol sau 2-hidroxitoluen




