Forţe intermoleculare. Legături de hidrogen.
Partajeaza in Google Classroom

Transcript
legătura Ionică și legătura covalentă
despre care am vorbit lecțiile
trecute sunt legături puternice
care se stabilesc între ei Ion
Sau atom Rezultatul este formarea
compușilor ionici respectiv a moleculelor
Care sunt compuși chimici stabili
de ce aceste legături sunt Forțele
care țin împreună sau Ioni din
compuși chimici legăturile covalente
și legăturile ionice se mai numesc
și forțe intramoleculare aceste
tipuri de legături Explică de ce
și cum interacționează atomii sau
Ione dar mie Explică deosebirile
dintre stările de agregare De ce
solidele au formă și volum propriu
lichidele iau forma vasului în
care stau iar gazele umplu în vasul
în care sunt închise dar îl părăsesc
imediat ce acesta este deschis
starea de agregare proprietățile
închide lor gazelor și solidelor
presiunea de vapori punctele de
fierbere și punctele de topire
adică temperatura de fierbere și
temperatura de topire și multe
alte proprietăți ale substanțelor
sunt explicate printări a forțelor
intermoleculare forțele ce se exercită
între particulele substanțelor
Ați observat diferența când vorbim
de forțele intramoleculare ne referim
la Forțele care acționează în interiorul
moleculei Deci legăturile covalente
sau ionice care țin împreună atomii
sau Ion iar când vorbim de forțe
intermoleculare ia referim la Forțele
dintre molecule care oferă proprietățile
diferite ale substanțelor orice
substanță e alcătuită din particule
aceste de particule pot fi Uite
de exemplu cazul diamantelor și
al metalelor diamantul e format
numai din atomi de carbon iar Metalele
de exemplu o bucată de fier formată
numai din atomi de fier substanțele
mai pot fi alcătuite și din molecule
e vorba de substanțele compuse
precum apa și zahărul aceasta fiind
formula moleculei de apă iar aceasta
fiind formula moleculei de zaharoză
principalul component din zahăr
tot din molecule sunt alcătuite
și substanțele simple precum oxigenul
sau azotul din aer sau substanțele
mai pot fi alcătuite din Ioni Spre
exemplu clorura de sodiu sau sarea
de bucătărie cu formula a natriu
clor Așadar responsabile de proprietățile
fizice diferite ale tuturor substanțelor
Și decide stările de agregare diferite
sunt interacțiunile dintre molecule
care se manifestă prin Forțele
de atracție dintre molecule adică
prin Forțele intermoleculare forțele
intermoleculare sunt mult mai slabe
decât forțele intramoleculare cele
mai importante forțe intermoleculare
sunt legătura de hidrogen interactii
ledi polipol și Forțele de dispersie
loan to interact iile dipoli dipoli
și Forțele de dispersie London
se mai numesc și forțe van der
waals asta ca omagiu pentru atribuție
a lui Iohannis deidrick Vanderbilt
la studierea interactii lor dintre
molecule în funcție de tărie acestor
forțe substanțele se găsesc în
cele trei stări de agregare să
zicem că acestea ar fi moleculele
dintre o substanță Haideți să vedem
ce se întâmplă cu moleculele dacă
forțele intermoleculare sunt slab
moleculele se împrăștie deci acum
Avem stare de agregare gazoasă
dacă crește Tăria forțelor dintre
molecule ele se vor apropia până
când ajung în stare lichidă dacă
creștem Tăria forțelor intermoleculare
și mai tare moleculele se vor apropia
urmând structură ordonate pe scurt
în funcție de Tăria forțelor care
acționează între molecule avem
substanțe în cele trei stări de
agregare dacă forțele intermoleculare
sunt slabe înseamnă că substanța
A gazon dacă forțele intermoleculare
sunt un pic mai puternice substanțe
în stare lichidă și dacă sunt și
mai puternice substanța va fi în
stare solida trecerea unei substanțe
din stare solidă în stare lichidă
și apoi în stare gazoasă presupune
învingerea forțelor care se manifestă
între particulele ei Asta se poate
face prin schimbarea temperaturii
sau prin schimbarea presiunii am
văzut că în cazul compușilor ionici
Forțele de atracție electrostatică
dintre Ion sunt foarte puternice
astfel compușii ionici au de cele
mai multe ori puncte de iubire
foarte ridicate în cazul substanțelor
formate din molecule starea de
agregare a acestora e determinată
printre altele și de masa lor moleculară
adică de masă a moleculelor care
formează substanța pentru o serie
de compuși cu structuri asemănătoare
Masa moleculară adică creșterea
masei moleculare duce la creșterea
punctelor de topire și de fierbere
în seria respectiv punctele de
topire și de fierbere vă reamintesc
se referă la temperatura la care
o substanță se topește respectiv
temperatura la care o substanță
fier de exemplu în seria hidroelectrica
14 sau grupa 4 principală hidrura
de carbon hidrura de siliciu hidrura
de germaniu și hidrura de staniu
punctele de topire crezi că o dată
cu masa moleculară după cum vedem
în această diagram în aceeași diagrama
reprezentat și punctele de topire
ale hidruri lor elementelor din
grupa 16 sau șase principală adică
apa Draw genul sulfurat si hidro
rile seleniului și telurul regularitatea
de care am pomenit mai înainte
e valabilă numai în cazul ultimelor
trei figuri punctele lor de topire
cresc odată cu creșterea masei
moleculare acest lucru vedem foarte
clar din diagramă nu este valabil
și pentru apă care ar fi trebuit
să aibă punctul de topire mai coborât
decât al hidrogenului sulfurat
acest comportament al apei se explică
prin existența unor forțe intermoleculare
puternice între moleculele de apă
mai puternice decât cele care există
între moleculele celorlalte hidro
aceste forțe se numesc legături
de hidrogen legătura de hidrogen
e un tip special de legătură intră
moleculară și este de natură electrostatică
adică e vorba tot de niște sarcini
electrice opuse care se atrag doar
că sarcini parțiale opus legătura
de hidrogen se stabilește între
molecule cu legături covalente
polare care sunt formate din atomi
de hidrogen si un atom cu electronegativitate
mare Deci un atom de hidrogen participat
la o legătură polară Realizează
o legătură de hidrogen cu electroni
neparticipanți ai atomului puternic
electronegativ și cu volum care
aparține unei molecule vecine de
obicei aceștia atom puternic electronegativ
și cu volum mic sunt clorul oxigenul
și azot exemple de molecule care
formează legături de hidrogen sunt
acidul clorhidric apa sau amoniacul
Așadar acestei legături dintre
moleculele de apă faca aceasta
să se comportă diferit față de
celelalte molecule din serie bun
Dar poate vă întrebați De ce e
legăturile de hidrogen nu se manifestă
și în moleculele de hidrogen sulfurat
de exemplu pentru că la urmă urmei
și le conțin atomi de hidrogen
implicați în legături covalente
polare sau de ce în seria de acizi
ai halogenilor acid clorhidric
clorhidric și acidul bromhidric
numai acidul clorhidric formează
legături de hidrogen cu alte molecule
de acid clorhidric răspunsul ține
de evaluare a electronegativitatii
lor elementelor observăm că diferența
de electronegativitate dintre oxigen
și sulf Care este 3 minus 2 Deci
unul sau dintre flori și clor Care
este tot unu este foarte mare e
mult mai mare decât diferența de
electronegativitate dintre sulf
și tellur sau selenium sau decât
diferența de electronegativitate
dintre clor și ceilalți halogeni
Ba mai mult să ne reamintim că
volumul Atomic al elementelor crește
de sus în jos în grupă deci atomi
de oxigen și flori au cele mai
mici volume atomice din grupele
lor pentru o mai bună înțelegere
vom analiza ei modul în care se
formează legăturile de intro gen
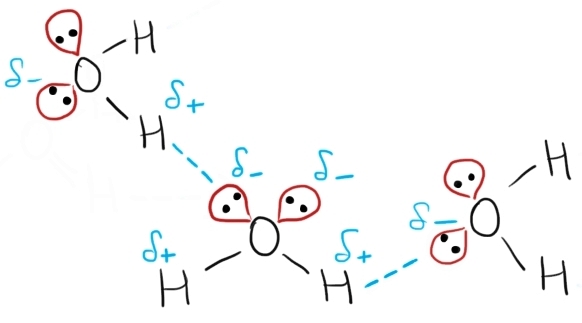
între moleculele de apă Am văzut
că oxigenul are electronegativitate
mare Deci acesta atrage electroni
în Legături chimice polare spre
el după cum știi molecula de vineri
din această cauză un bol cu Polul
negativ la atomul de oxigen iar
Polul pozitiv la atomul de hidrogen
la fel și la cealaltă legătură
polară a apei Polul pozitiv la
atomul de indieni când o altă moleculă
de apă se apropie de prima între
Polul negativ al uneia și cel pozitiv
al celeilalte se stabilește o forță
de atracție electrostatică Adică
o legătură de hidrogen Acestea
se simbolizează prin trasarea unei
linii punctate între atomii între
care se stabilește interacția intermoleculare
legătura de hidrogen este cea mai
tare dintre forțele intermoleculare
deoarece volumul mic al atomilor
de hidrogen primite ca cele două
molecule de cine să se apropie
foarte mult deci în cazul moleculelor
pe care le am dat exemplu apa acidul
clorhidric și amoniacul legătura
covalentă polară care deformează
este mult mai puternic polarizată
pe diferență de alte molecule polare
precum hidrogenul sulfurat sau
acidul clorhidric unde e diferența
de electronegativitate dintre hidrogen
și celelalte tău nu este atât de
mare legăturile de hidrogen formate
între moleculele de acid clorhidric
au cea mai mare tărie urmează Tăria
legăturilor de hidrogen dintre
moleculele de apă și apoi Tăria
legăturilor de hidrogen dintre
molecule de amoniac dacă legăturile
de hidrogen dintre moleculele de
a citi flori sunt cele mai puternice
atunci de ce la temperatura camerei
acidul clorhidric este gaz iar
Apa este lichid E bine Ia adevărat
că legătura dintre și drojin și
flori este mai puternic polarizate
decât legătura dintre dar trebuie
să luăm în considerare și faptul
că în molecula de acid clorhidric
există un singur atom de hidrogen
pe când molecula apei conține doi
atomi de hidrogen deci moleculele
de apă pot forma de două ori mai
multe legături de hidrogen față
de acidul clorhidric și astfel
acidul fluorhidric are punctul
de fierbere mult mai mic față de
apă care are nevoie de 100 de grade
Celsius pentru a se transforma
în stare gazoasă legăturile de
hidrogen sunt foarte foarte importante
pentru organismul nostru dacă ne
uităm la moleculele care formează
ADN ul vom vedea că acestea sunt
tinute împreună prin legături de
hidrogen Deci structura aceasta
a ca o scară în spirală ADN lui
Este posibilă numai prin aceste
legături legăturile de hidrogen
sunt importante pentru a menține
nu numai structura ADN eu lui proteine
lor și enzimelor și altor molecule
importante din organismele din
toate aceste molecule au în componența
lor grupări nh sau o h pentru că
ne alungi destul de mult în explicații
în această lecție vom continua
în lecția viitoare discuția despre
proprietățile apei care noi suntem
foarte obișnuit o să am văzut deja
că prin comparație cu alte substanțe
apa are niște proprietăți care
nu se prea încadrează în tiparele
obișnuite