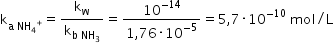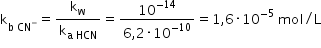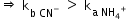Hidroliza sărurilor provenite de la acizi slabi și baze slabe
Tag-uri
Partajeaza in Google Classroom

Transcript
ai rămas să vedem ce se întâmplă
la hidroliza sărurilor provenite
de la acizi și baze slabe aceste
săruri sunt formate dintre un Casian
provenit de la o bază slabă care
e în soluție apoasă se comportă
ca un acid slab iar anionul acestor
săruri provine de la un acizi care
în soluție apoasă se comportă ca
o bază slabă nici vedem că spre
diferență de celelalte categorii
de săruri în acest caz ambii Ioni
reacționează cu apa prin hidroliză
rezultă o soluție care poate fi
acidă bazică sau neutră totul în
funcție de turații de relativă
și Tăria bazică relativă ați Ion
luat separat Deci ne vom folosi
Constanța de aciditate a acidului
Slav și de Constanta de bazicitate
a bazei sunt la baie pentru a ne
dea seama de caracterul soluției
apoase de sare soluție are caracter
acid atunci când Constanța de aciditate
acidului Slav este mai mare decât
Constanța de bazicitate a bazei
slabe Iar atunci când Constanța
de aciditate este mai mică decât
Constanța de bazicitate a de slaba
soluția are caracter bazic și dacă
cele două constante sunt egale
atunci soluția are caracter neutru
care să vedem dacă o soluție apoasă
de cianură de amoniu este bazic
acidă sau neutră ionul amoniu provine
de la amoniac Care este o bază
slabă anionul cianură provine de
la acidul cianhidric Care este
un acid slab primul pas pentru
a determina caracterul acestei
soluții apoase de sare este să
scriem reacțiile care au loc între
acest iunie istoric și apă ioniu
se comportă în apă ca un acid slab
donând un Proton unei molecule
de apă astfel se formează un Ion
hidroniu Ionuț shanora adică anionul
cianurii de amoniu se comportă
ca o bază slabă în prezența apei
anilor cianură acceptă un pluton
de la apă prin acest proces formând
dusei și uneori hidroxil dintre
aceste două echilibre reacția care
se deplasează cel mai mult spre
dreapta influențează pe HG soluției
Dacă primul echilibru este deplasat
mai multe dreapta decât al doilea
Nu mai bea un plus de Ion hidroniu
în soluție Deci soluția are un
caracter la bazin în caz contrar
dacă al doilea este deplasat mai
multe spre dreapta față de primul
Atunci înseamnă că avem un soluție
un plus de Ioan hidroxil ceea ce
face ca soluția noastră să aibă
un caracter slab bazic Așadar în
continuare trebuie să comparăm
Constanța de aciditate a ionului
amoniu cu Constanta de bazicitate
a ionului cianură în cărții pe
internet în tabelele cu valori
ale constantelor de aciditate și
bazicitate so listate numai valorile
corespunzătoare compușilor moleculari
nu și ionilor ne găsim valoarea
constantei de bazicitate a amoniacului
și valoarea constantei de aciditate
acidului cianhidric asta înseamnă
că trebuie să calculăm aceste două
constante și abia apoi le putea
compara pentru aceasta ne folosim
de relația următoare avem Constanța
de aciditate a unui acid înmulțită
cu Constanța de bazicitate a bazei
conjugate egal cu produsul ionic
al apei această relație este valabilă
pentru un cuplu acid baza conjugată
exemplu pentru cuplul baza acid
conjugat amoniac Ioan amoniu avem
Constanța de bazicitate a amoniacului
egală cu 1 ori 10 la minus 5 moli
pe litru și Cunoscând această valoare
Care este tabela de aflăm Constanța
de aciditate a ionului amoniu Care
este egală cu raportul dintre produsul
ionic al apei și Constanța de bazicitate
amoniac efectuând calculul și am
obținut valoarea constantei de
aciditate a ionului amoniu și la
fel pentru cupluri acid baza conjugată
acid cianhidric Ion cianură avem
Constanța de aciditate acidului
cianhidric așa că Putem afla foarte
simplu Constanța de bazicitate
a ionului cianură Care este egală
cu raportul dintre produsul ionic
al apei și Constanța de aciditate
a acidului cianhidric efectuând
calculul și a obținut și valoarea
constantei de bazicitate acestea
două sunt valorile pe care trebuie
să le Compară și vedem că Constanta
de bazicitate a ionului cianură
este mai mare decât Constanța de
aciditate a ionului amoniu acest
lucru înseamnă că reacția de acceptare
a unui Proton de la apă de către
Ionuț Ion ură deplasată mult mai
tare spre dreapta față de reacția
de cedare a unui Proton către apă
de de către Ion lună amoniu Deci
în soluția de cianură de amoniu
se vor eliberarea mai mulți Ioni
hidroxil notiuni hidroniu și astfel
știind că soluția are un caracter
slab bazic și acum Haideți să utilizăm
ceea ce am învățat despre hidroliza
sărurilor pentru a prezice caracterul
acid bazic sau neutru al soluțiilor
apoase acestor trei săruri avem
aici sulfatul acid de sodiu cloratul
de potasiu și benzoatul de sodiu
sulfatul acid de sodiu este un
CAS interesant format dintr un
catren care provine de la o bază
tare hidroxidul de sodiu și e din
doua nanian canionul Sulfat acid
Care este bună onion ala sidul
uiti protic acid sulfuric adică
este în anionul care se obține
după prima treaptă de ionizare
a acidului sulfuric Ion ghid reacționează
cu apa pentru a produce un Ion
hidroniu chiar dacă provine de
la un acid tare mai are un Proton
în structura lui și se comportă
în apă ca un acid slab după cum
bine știm unul de sodiu nu este
capabil să facă schimb de protoni
cu Asa dar datorită ionului Sulfat
Taci se formează Ion de hidroniu
și soluția are caracter acid cloratul
de potasiu forma dintre un Catalin
care provine de la o bază tare
hidroxidul de potasiu și ghinionul
perclorat care provine de la un
acid tare acidul percloric și acidul
percloric este un acid tare nici
unul dintre acești doi Ion reacționează
cu apa astfel că la hidroliză a
preparatului de potasiu în apă
obținem o soluție neutră benzoatul
de sodiu este format dintr un Cassian
care provine de la o bază tare
hidroxidul de sodiu și din anionul
benzoat care provine de la un acid
slab acidul benzoic știind că Ionuț
de sodiu reacționează cu apa în
schimb ionul benzoat se comportă
ca o bază slabă în apă acceptând
un Proton de la o moleculă de apă
și produce Ion hidroxil vedem astfel
că la hidroliza benzoatului de
sodiu se obține o soluție cu caracter
bazic mai departe în calcula pe
H lunei soluții de sare avem o
soluție de acetat de potasiu 0 molară
și trebuie să îi calculăm pe H
cunoaștem Constanța de aciditate
a acidului acetic și exponentul
de aciditate al acidului acetic
și trebuie să aflăm pe hașuri soluției
mai întîi trebuie să identificăm
ionii din care este formată Sarea
cationul este Ionuț de potasiu
care provine de la o bază tare
așa dar nu reacționează cu apa
anionul este ionul acetat care
provine de la acidul acetic un
acid slab care prezența apei se
comportă ca bază slabă acceptând
un Proton de la apă Deci timp de
joacă Tulcea noastră va avea un
caracter bazic Constanta de bazicitate
a ionului acetat este egală cu
raportul dintre produsul ionic
al apei și Constanța de aciditate
a acidului conjugat adică acidului
acetic efectuând calculul și am
obținut o valoare a Constantin
de bazicitate mai mică decât 10
la minus 5 ceea ce înseamnă că
pentru a afla pe H la aceste soluții
putem folosi această formulă pentru
ph valabilă pentru bazele slabe
care au Constanța de bazicitate
mai mică decât 10 la minus 5 înlocuirea
această formulă datele pe care
le cunoaștem efectuând acest calcul
obținem în pe H egal cu 9 Dacă nu
vă place formulă Și nu vrei să
învățați pe de rost este o cale
de a afla pe hol unei astfel de
soluții ne putem folosi de relația
generală pe hașu lui și anume H
egal minus logaritm din concentrația
molară a ionilor hidroniu pentru
a putea aplica această formulă
Trebuie mai întâi să aflăm concentrația
molară A ionilor hidroniu deci
pentru a putea aplica această formulă
Trebuie mai întâi să aflăm concentrația
molară ionilor hidroniu mai întâi
trebuie să aflăm concentrația molară
a ionilor de hidroxid pentru asta
ne vom folosi de această relație
relație valabilă atunci când Constanța
de bazicitate este mai mică decât
10 la minus 5 lucru pe care valoarea
noastră îl îndeplinește Așadar
efectul acest calcul și obținem
concentrația molară a ionilor de
hidroxil pentru a afla concentrația
molară a ionilor hidroniu ne folosim
de produsul ionic al apei De unde
rezultă că concentrația molară
a ionilor hidroniu este egală cu
produsul ionic al apei supra concentrația
ionilor hidroxid efectuam și acest
calcul Ciao obținut și concentrația
molară a ionilor hidroniu acum
pentru a afla pe hol îmi trebuie
decât să înlocuim această valoare
în această formulă a pe Hush lui
de pe h a soluției noastre este
egal cu logaritm zecimal negat
is din 0 ori 10 la minus 9 și efectuând
acest calcul obținem tot 9 și 2

 NH3 (aq) + H3O+(aq)
NH3 (aq) + H3O+(aq)