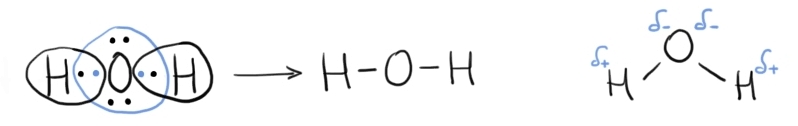Legătura covalentă şi compuşii moleculari
Partajeaza in Google Classroom

Transcript
am discutat în lecția trecută despre
legăturile ionice și compușii ionici
legăturile ionice se formează de
cele mai multe ori în cazurile
în care atomii sunt pe de o parte
e foarte hotărâți să cedeze electroni
iar Pe de altă parte foarte hotărâți
să primească de pe undeva unde
electron sau alți sau mai mulți
electroni astfel are loc un transfer
de electroni atomii se transformă
în ioni ioni pozitivi iar alții
negativi iar apoi forțele electrostatice
dintre sarcinile lor opuse îi fac
să fie puternică atrași unul de
altul și să formeze astfel compuși
ionici Dar ce se întâmplă când
avem atomi care nu sunt atât de
convinși că vor fi să primească
sau fi să scape de electronilor
de valență în acest caz apare legătura
covalentă dacă vă mai amintiți
electronegativitatea este Puterea
cu care un element atrage electron
dintru legătură covalentă legătura
covalentă se realizează în două
cazuri primul ar fi că se realizează
între atomii identici ai elementelor
cu electronegativitate mare adică
între nemetale iar în al doilea
cazul legătura covalentă se realizează
între atomii diferiți cu electronegativitate
apropiate ca valoare din cauză
că între aceștia Tomi nu există
deloc diferență de electronegativitate
sau există diferență foarte mici
structura electronică stabilă pe
care toți atomii și eu doresc nu
se poate realiza prin transfer
de electroni de la un atom la el
pentru a forma compuși moleculari
adică compuși cu legături covalente
atomi pun în comun electroni din
stratul de valență se formează
adevărate legături între atomi
numite legături covalente care
sunt lichide și sunt orientate
în spațiu predi Ferenț ă de legăturile
ionice care nu sunt orientate în
spațiu după cum am mai zis există
două tipuri de legături covalente
Acestea se numesc legături covalente
polare și legături covalente nepolare
molecula de hidrogen ne oferă cel
mai simplu exemplu de legătură
covalentă fiecare atom de hidrogen
are stratul de valență un electroni
de fapt în tot învelișului electronic
atomul de hidrogen are un singur
electron 1 S1 fiind configurația
acestuia De ce hidrogenul ar fi
mai mulțumit cu o configurație
mai stabilă de dublet așa cum are
Adică 1 S2 pentru asta doi atomi
de hidrogen pun în comun câte un
electron atomii de hidrogen Se
apropie astfel încât electronii
să aparțină ambelor atom acum fiecare
atom are o structură stabilă de
dublet vedem si acesta dar și atomul
acesta o legătură covalentă corespunde
unei perechi de electroni puși
în comun de doi atomi de perechea
de electroni se numește dublez
de electroni și reprezintă o printre
o linie care unește cei doi atomi
legați în acest aceasta este de
ce molecula de hidrogen în moleculă
de hidrogen dubletul de electroni
format aparține În egală măsură
celor doi atomi această împărțire
frățească explicată prin faptul
că fiind atom identice au electroni
electronegativitate identice De
ce fiecare din aceștia Tomi trage
de perechea de electroni cu o putere
egală și pentru că cei doi electroni
sunt distribuții în mod egal între
cele două nuclee în molecula de
hidrogen nu există zone distincte
de sarcină pozitivă sau negativă
adică nu există Poli asta înseamnă
că legătura covalentă formată se
numește legătură covalentă nepolară
aceste legături nepolare se stabilesc
de aici între atomi identici de
nemetale la fel se formează și
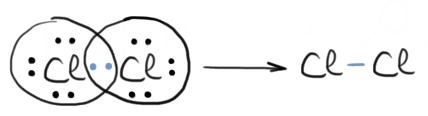
molecula de clor atomul de clor
are configurația neon 3 s 2 3 pe
5 b c avem șapte electroni în stratul
de valență săi repartizăm tot cu
puncte prin simboluri Lewis clor
doi doi șapte și celălalt Lord
Deci doi atomi de clor pun în comun
câte un electron Și fiecare are
astfel configurație stabilă de
octet pe ultimul strat rezultă
molecula de clor formată printr
o legătură covalentă nepolară aceste
legături în nepolare sunt simple
există și legături covalente nepolare
multiple este cazul moleculei de
oxigen sau la molecule de azot
oxigenul are 6 electroni de valență
îi vom desena Așa Deci pentru a
ajunge la opt electroni de valență
aceștia Tomi vor împărți nu naci
două perechi de electroni acestea
două acum o fiecare atom are opt
electroni de valență si astfel
rezultă molecula de oxigen care
conține o legătură covalentă nepolară
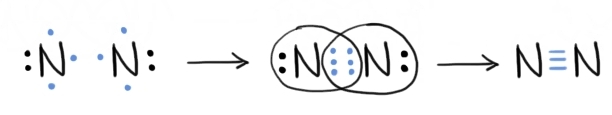
dublă molecula de azot se obține
în urma interacției dintre doi
atomi de azot ce au configurația
electronică 1 s22 s22 pe trei Deci
avem cinci electroni în stratul
de valență Așadar acestui atom
îi mai lipsesc trei electroni pentru
a avea octeți pe ultimul strat
îi vom Reprezentați și pe aceștia
folosi structuri Lewis de doi atomi
de azot pun în comun câte trei
electroni de această dată deci
trei perechi de electroni și rezultă
o legătură covalentă nepolară triplă
pentru că am definit nepolare ne
este deja mai ușor să ne dăm seama
că legăturile covalente polare
se stabilesc între atomi cu electronegativitate
diferită și sunt tot rezultatul
punerii în comun de electroni cuplați
din stratul de valență în acest
sens Haideți să analizăm mai îndeaproape
molecula de apă ne va ajuta Oricum
se intelege mai bine proprietățile
care fac apa un compus atât de
util în cele mai multe ilustrații
apa e reprezentată astfel o sferă
voluminoasă ca fiind oxigenul și
două mai mici care denotă cei doi
atomi de hidrogen atomul de oxigen
are următoarea configurație electronică
1 s22 s22 pe 4 în ultimul strat
oxigenul are doi electroni necuplati
ca să le convinge Reprezentați
substratul 2p cu cei trei orbitali
pe unde are patru electroni și
în acest fel respectând regula
lui hund adică cea care spune că
numai după ce toți orbitalii unui
substrat sunt ocupați cu câte un
electron de același spin se trece
la completarea cu cel de al doilea
despina Deci un atom de oxigen
pune în comun cei doi electroni
cuplați cu câte un electron provenit
de la doi atomi de hidrogen în
această moleculă oxigenul are configurație
stabilă de octet Iar cei doi atomi
de hidrogen au o configurații stabile
de duble rezultă molecula de apă
se mai poate reprezenta și astfel
apa ținând cont de geometrie a
moleculei cea mai importantă caracteristică
a moleculei de apă pentru înțelegerea
reacțiilor chimice este că deși
per total e o moleculă neutră din
punct de vedere electric sarcină
electrică nu e distribuită în mod
egal în moleculă cu alte cuvinte
electronii puși în comun nu sunt
distribuiți uniform între atomii
de oxigen și hidrogen asta deoarece
oxigenul are electronegativitate
mai mare decât genul Deci are o
putere mai mare de a atrage electroni
din legătură spre se formează astfel
doi dipoli dipolul fiind o structură
cu zone cu densitate de sarcină
parțial pozitivă notate cu Delta
Plus în jurul atomilor de hidrogen
și cu zone de sarcină parțial negativă
notate cu Delta minus în jurul
atomului de oxigen litera grecească
Delta e pentru a reprezenta faptul
că sarcina e parțială De ce nu
e o sarcina negativă sau pozitivă
completă ca să zic așa ca în cazul
ionilor care cedează sau acceptă
Electro această distribuție inegală
de sarcini Falcă face din molecula
de apă o moleculă polară proprietatea
apei de a fi un bun solvent pentru
compuși ionici Și pentru alte substanțe
cu molecule polare este datorată
existenței dipolului în moleculele
de apă un alt exemplu de molecula
polară este molecula de acid clorhidric
acidul clorhidric se formează prin
punerea în comun a câte unui electron
din partea unui atom de hidrogen
și a unui atom de clor hidrogenul
își realizează configurația stabilă
de dublet iar clorul de octet atomul
de clor are o electronegativitate
mai mare decât androginului Ce
atrage mai puternică electroni
din legătură de scena molecula
de acid clorhidric sarcină parțială
negativă revine clorului iar cea
parțial pozitivă revine hidrogenului
așa dar am învățat că atunci când
doi atomi formează o legătură electronul
sau electronii implicați nu sunt
neapărat Împărțiți în mod egal
între cei doi atomi comparând diferența
dintre electronegativitatile celor
doi atomi de dintre electronegativitatile
atomilor era asta e foarte ușor
de făcut deoarece majoritatea tabelelor
periodice afișează și ele negativitatea
elementelor dacă nu Găsiți foarte
ușor aceste valori pe Internet
de exemplu această imagine care
prezintă electronegativitatile
tuturor elementelor de ce comparând
electronegativitatile celor doi
atomi implicați în legătură putem
determina tipul legăturii care
se formează adică putem determina
dacă o legătură este Ionică Deci
eu dacă un atom ia un electron
de la celălalt atom sau dacă o
legătură este covalentă polară
adică electronul este pus în comun
dar își petrece majoritatea timpului
lângă atomul cu electronegativitate
mai mare sau mai putem determina
dacă legătura covalentă nepolară
când electronii sunt împărțiți
în mod egal de cei doi atomi implicați
uitând un Nela valorile diferențelor
de electronegativitate e bine de
știut că dacă această diferență
e mai mare decât doi semne că e
vorba de o legătură Ionică Haideți
să vedem diferența în cazul clorurii
de sodiu clorura evaluarea 3 iar
sodiul are electronegativitatea
0 deci diferența este de 2 iar compusul
este Ion trebuie să fac o precizare
importantă am găsit surse în care
diferența de electronegativitate
dintre sodiu și clor era trecută
ca fiind fi 2 fi 2 asta se întâmplă
atunci când se lucrează cu valori
aproximative apare în fiecare dimineață
în alt fel Dar pentru ce avem noi
nevoie e suficient acesta Bell
în continuare când diferența de
electronegativitate este între
0 și doi vorbim despre o legătură
covalentă polară este cazul acidului
clorhidric putem să o și verifică
știind că clorul are valoarea 3
genul are 2 deci diferența de 0 ne
confirmă că legătura e polară când
diferența este mai mică de 0 vorbim
despre o legătură covalentă nepolară
e cazul moleculei de clor unde
e diferența este de 0 având în
vedere că e vorba de atomi identici
în cazul moleculelor nepolare există
și niște excepții există cazuri
de molecule care deși sunt formate
prin legături covalente polare
ele sunt în ansamblu nepolare e
vorba de moleculele cu structură
metrică cauza este compensarea
reciprocă a Adi polilor Formați
de exemplu molecula de Metan carbonul
are patru electroni de valență
între carbon și cei patru atomi
de hidrogen se stabilesc legături
covalente polare simple geometria
molecule este însă una regulată
rezultanta forțelor din dipoli
formații este 0 iar molecula per
ansamblu este nepolară alte exemple
de astfel de molecule sunt tetraclorura
de carbon sau dioxidul de carbon
se observă simetria Deci aceste
molecule simetrice sunt nepolare
în lecțiile viitoare vom continua
cu legătura coordinativă și combinațiile
complexe aer apoi vom vorbim și
despre interacțiunile dintre molecule
adică Forțele care țin împreună
substanțele din jurul nostru