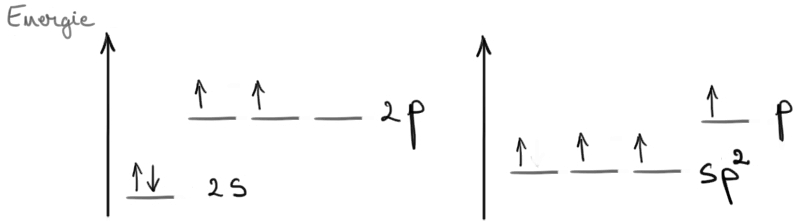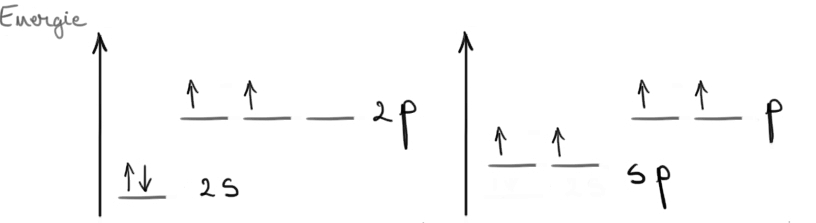Legături covalente în compuşii organici
Partajeaza in Google Classroom

Transcript
după cum am văzut în lecția introductivă
despre chimie organică lor actuală
se cunosc peste 2 milioane de compuși
care conțin Carpatică un număr
cu mult mai mare decât formează
toate celelalte elemente la un
loc Acest lucru se întâmplă deoarece
carbonul care are patru electroni
de valență are tendința cea mai
pronunțată de asigurați Adio Buna
rangoon de electroni astfel carbonul
poate forma patru legături covalente
cu alții atom de carbon sau cu
atomii elementelor organogene este
singurul element care poate forma
un număr practic Infinite legături
covalente cu Alina rând în acest
fel lanțuri de atomi de carbon
care știm data trecută că se numesc
Catena Sibiu deștepți iar fizice
carbonul în grupa 14 cu care le
formează nu sunt atât de puternice
și nici de pula atât de variate
pentru cele formate de Carpați
aceste proprietăți îi prind carbonului
să formeze milioane de compuși
necesare pentru a crea o baterie
sau Bun deci am zis că atomul de
carbon are patru electroni de valență
aceasta este reprezentarea Luisa
celor patru electroni care prezintă
un electron intim Care este configurația
electronică a carbonului carbonul
are 6 electroni înveliș Deci 1
S2 2 S2 și doi pe doi acesta este
stratul de valență pentru a vedea
mai clar aranjarea electronilor
putem scrie configurația electronică
și acest orbitalul luminos complet
ocupat cu doi electroni de spin
opus apoi avem stratul 2 cu orbitalul
2s complet ocupat și mai rămân
doi elevi tron care vor fi are
trei orbitali de tip fel este foarte
ușor să vedem că atomul are doi
orbitali monoelectronici adică
doi orbitali care conțin fiecare
câte un fura având aceeași 4 electroni
pe ultimul strat carbonul poate
forma patru legături covalente
legăturile covalente din compușii
organici pot fi simple duble sau
haideți la ne reamintim Ce este
legătura covalentă se formează
prin punerea întrepătrunderea a
doi orbitali atomici mon electronice
formează astfel unul molecular
de legătură să vedem de exemplu
la realizarea legăturii covalente
din molecula c din platoul de hidrogen
care are un electron în orbitalul
unui participă Da legătură cu acest
organ atomul de clor are electronii
repartizați electronii orbitalul
122 S6 electronice trei orbitali
12 doi electroni în orbitalul 3S
și 5 Electro repartizați în cei
trei ore Deci clorul participă
la formarea legăturii covalente
cu acestora gitelman electron ce
reprezenta în acest fel legătura
covalentă din molecula hidrogenul
care participă la legătură cu un
electron și clorul cu cei șapte
lecturi mesei de vale acesta fiind
acestia doi sunt electronii care
vor fi puși și se formează legătura
covalentă prin care hidrogenul
se obține o configurație stabilă
de dublet iar clorul obține configurația
stabilă de octet reprezenta mai
simplu legătura covalentă două
mici electronice care sunt grupă
cuvânt pentru a forma legătura
cu Marius care are formă sferică
și orbitalul pe care are forma
video Paula iar acesta este orbitali
moleculari de legătură în cazul
atomului de carbon orbitali atomici
în stare fundamentală Nu asigură
întrepătrunderea maximă necesară
formării legăturilor covalente
stabilirea în timpul reacțiilor
chimice orbitalii în care se găsesc
electronii de valență suferă un
proces de ridicare e bre dar ea
e un fel de contopire a orbitalilor
atomici în orbitalii hibrizi adică
în momentul stabilirii legăturilor
covalente atomul de carbon bar
și atomi de oxigen își distribui
electroni de pe ultimul strat în
noi orbitali în orbitalii hibrizi
aceștia o nouă formă o nouă energie
și o nouă orientare în spațiu orbitalii
hibrizi au energii mai mici volum
mai mare Asta înseamnă că e mai
ușor pentru electroni să formeze
legătura nu mai au nevoie să cheltuie
foarte multe energie Deci formarea
legăturilor covalente este favorizată
atât de energetică și astfel se
asigură formarea unor molecule
stabili Așadar acest proces de
redistribuirea electronilor în
ordine este procesul de hibridizare
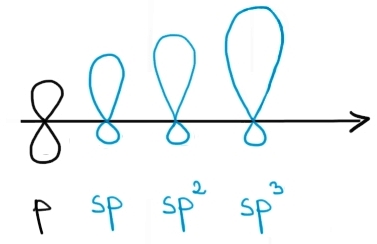
cele mai importante din zori adoptate
sunt respectiv F2 și este atomul
de carbon Adoptă toate cele trei
tipuri de hibridizare funcție de
natura legăturii covalente pe care
o Stabilește cu aicea Adică dacă
e vorba de o legătură simplă dublă
sau putem compara volumele orbitalilor
hibrizi cu volumul acesta este
orbitalul este care rezultatul
contopirii dintre un orbitali s
și vorbit le formează doi Care
e rezultatul contopirii dintre
un orbitali s și doiul și expectorant
cel mai voluminos fără este rezultatul
divizorii dintre Eurovita spitalizarea
atomilor de carbon Explică geometria
moleculelor compușilor organici
adică Explică unghiului dintre
valențe și lungimea legăturii carbonului
are are loc între orbitalul doi
ani și orbitali 2 în cazul hibridizării
este 3 din combinarea lui 2 cu
cei trei orbitali 2 rezultă patru
orbitali este 3 care au forma Biloba
ala cu un loc de știință așa cum
am văzut mai devreme patru orbitali
au aceeași energie mai mare decât
orbitalului 2s ce mai mică decât
energia orbitalilor 2t orientarea
spațială este tetraedri că unghiul
puțin mai mari de 109 grade îndreaptă
prin intermediul acestor orbitalii
hibrizi aspect trei atomi de carbon
formează numai legături covalente
simple legături covalente se mai
numesc și legături legături Sigma
se formează când doi atom pune
în comun pereche de la domnul de
carbon hibridizat sp3 poate forma
patru legături aceste molecule
carbonul este întotdeauna legat
de azi 4 atomi care pot fi atom
de carbon sau atomi a elementelor
organice exemplu aceasta este molecula
de metal care ilustrează orientare
a orbitalilor hibrid este vârful
unui tetraedru regulat este 2 3
orbitali s cu 2 orbitali îmbinare
din care vor rezulta trei orbitali
hibride noi și un orbital penița
Deci în cazul carbonului e vorba
de orbitalul 2s și doi dintre orbitalii
2 orbitali este doi au forma vinovată
cu au aceeași energie mai mare
decât orbitali s și mai mică decât
cei trei orbitali hibrizi sunt
orientați în plan către vârfurile
unui triunghi echilateral adică
excelent bătăliilor este 2 sunt
coplanare și au între ele unghiul
de 120 de g orbitalul Penny hibridizat
este orientat perpendicular pe
planul axelor orbitalilor aspect
doi Deci aici avem un unghi de
90 de grade ad despre doi realizează
trei legături stii Cu ce ai trei
orbitali hibrizi pentru oi iar
cu orbitalul pene hibridizat Realizează
o legătură Deci atomul de carbon
hibridizat sp2 Formează două legături
simple și o legătură dublă legătura
dublă este formată dintre o legătură
Sigma și o orbitalul molecular
fii se obține prin întrepătrunderea
laterală a doi orbi tie cu actele
paralele Acesta este un orbitali
moleculari iar aceasta este reprezentarea
unei legături duble între doi atomi
de carbon hibridizat sp2 aceasta
este legătura formată între doi
orbitali teniși Precizați aparținând
fiecare câte un atom de carbon
este legătura Sigma funcționează
destul de ce mai de carbon legați
prin o legătură Sigma să pot roti
liberi în jurul acestei legături
acest lucru e foarte important
pentru că numai legăturile Sigma
ofera acest fel de libertate de
mișcare pentru o suprapunere maximă
orbitalii pe trebuie să rămână
paralel rotația în jurul legăturii
centrale nu mai este posibil legătura
te blochează locația legături stii
această proprietate duce la formarea
insomniei stransa compușilor organici
despre care vom avea ocazia să
discutăm pe tigri de zarea spune
combinare a unui orbitali s cu
un orbitali p combinare din care
rezultă 2 orbitali și prize este
orbitali au aceeași energie mai
mare decât energia orbitalului
esti și mai mică decât energia
orbitalilor pe cei doi orbitali
este ala un unghi de 180 de grade
între cei doi orbitali pene și
precizați sunt orientați perpendicular
între ei și perpendicular pe AD
sau orbitali puțină imaginație
aici ca să vedem molecula în 3D
hibridizat SP are electronice cu
care realizează două legături simple
și mai are doi orbitali monoelectronici
prin întrepătrunderea laterală
a câte 2 ori pe an este de la cei
doi atomi se formează două legături
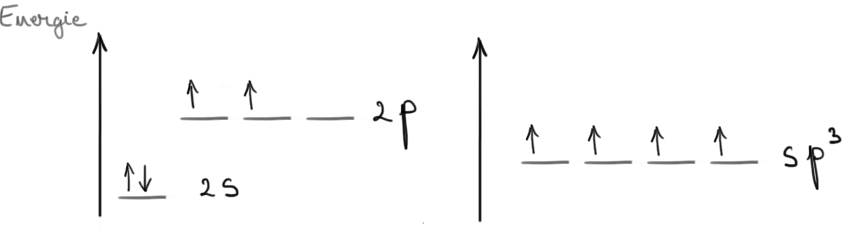
Așadar carbonul hibridizat SP Realizează
o legătură triplă și o legătură
Sau poate a realizat două legături
duble legături format dintr o legătură
Sigma și două legături pi Ce înseamnă
că între cei doi au participat
sau legătură se pun în comun trei
perechi de electroni aceasta este
structura un substanțe cu atom
de carbon în starea de hibridizare
este avem o legătură tripla formate
dintre o legătură Sigma și două
legături un alt exemplu este această
moleculă în care acesta atom de
carbon este deviza având două legături
Sigma una aici și una aici și două
legături pi un aici și una aici
azotul poate adopta și el Toate
aceste tipuri de fidelizare este
302 și este Așadar și azotul poate
forma legături duble sau poate
adopta nu mai spus vizarea influențează
lungimea legăturilor covalente
deci lungimea unei legături covalente
scade în această ce mai lungă legătură
este cea covalentă simplă a formează
cea dublă iar cea mai scurtă este
legătura covalentă triplă unei
legături covalente depinde printre
altele și de forma OBI talului
molecular de legătură care se formează
orbitali moleculari voluminoși
întrebăm mai redusa orbitalilor
atomici conduc la legături covalente
mai slab de aceea legătura pi este
mai slabă și mai reactivă legătura
Sibian legile viitoare Că legăturile
duble și triple care conține gâtul
fii te rog mai ușor decât legăturile
simplitatea este o caracteristică
foarte importantă a legăturilor
covalente legăturile carbon nemetal
e Unde e nemetalul poate fi oxigen
azot și fosfor sau halogeni sunt
legături covalente polare electronii
puși în comun sunt atrași cu mai
multă putere de către atomul de
nimeni acesta fiind mai rece decât
de care vă aflați în stări diferite
de identitate au caracter a trăgător
de electroni din atomul de carbon
hibridizat sp3 stingător de electroni
de carbon hibridizat sp2 este slabă
trăgător de electroni iar cele
hibridizat SP este mai atrăgător
legăturile carbon sp3 hidrogen
și carbon sp2 drojin sunt foarte
slab polare practic nepolare iar
legăturile carbon este hidrogen
sunt la Polar proprietățile fizice
și chimice ale substanțelor organice
iar structura moleculară depinde
de caracteristicile legăturilor
covalente pe care le conțin adică
depinde stabilitate a legăturii
covalente de orientare în spațiu
și de polaritatea lor Așadar vedem
că este foarte important Să înțelegem
cum se formează aceste legături
în moleculele organice rezumat
În acest tabel informațiile generale
despre legăturile covalente pe
care le întâlnim cel mai des în
substanțele organice carbonul care
are cu valență 4 poate forma a
legături simple duble sau triple
când este în stare de hibridizare
sp3 carbonul formează patru legături
Sigma adică patru legături covalente
simple Când este hibridizat sp2
carbonul formează trei legături
Sigma și o legătură Pi ceea ce
duce la formarea unei legături
duble și a două legături simplă
starea de hibridizare este carbonul
Formează două legături Sigma și
o legătură Pi Ce înseamnă formarea
unei legături triple și a unei
legături simple sau formarea două
legături duble azotul care are
cu valență A3 poate adoptat și
el după cum am spus mai devreme
toate cele trei stări de divizare
când este divizată este azotul
formează trei legături simple Când
este hibridizat sp2 formează legătură
dublă și o legătură simplă iar
în stare de divizare este azotul
formează o legătură cu oxigenul
poate adopta și el și bizare este
cazul în care poate forma două
legături ce când are orbitali în
stare fundamentală oxigenul poate
forma o legătură Sigma și o legătură
Pi Adică poate forma o legătură
alogeni hidrogenul au covalenta
1 aceștia noua de niciun fel de
hibridizare și formează numai legături
Sigma si așa dar acum știm cum
se leagă viitoare vom vedea și
structuri se formează datorită
acestor legături