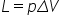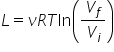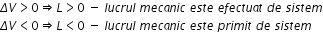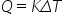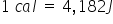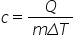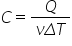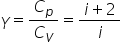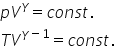Lucrul mecanic, căldura, coeficienţii calorici.
Tag-uri
Partajeaza in Google Classroom

Transcript
în cea de a opta lecții de termodinamică
glume introduce noțiunile de bază
de calorimetrie precum lucrul mecanic
căldură și coeficienți calorici
mânce pac lucrul mecanic 1 Ce este
calorimetria calorimetre Este domeniul
termodinamicii care studiază schimbul
de energie între sisteme termodinamice
în particular între un sistem și
mediul extern dacă sistemul termodinamic
este închis ceea ce înseamnă că
Masa lui este constantă sistem
închis înseamnă masa constantă
Sau dacă vreți numărul de moli
Constantin cel roșu lucru deci
în sistemele închise acest schimb
de energie poate avea loc în două
feluri ori prin efectuarea unui
lucru mecanic ori prin tu un transfer
de căldură să începem cu lucrul
mecanic lucrul mecanic este schimbul
de energie ce are loc prin variația
parametrilor de poziție în particular
a volumului sub acțiunea unei forțe
un proces izocor care are loc la
volum constant plin definiție lucru
mecanic va fi egal cu zero nu a
nu avem o variație a volumului
Deci prin definiție lucrul mecanic
este zero în proces apar presiunea
este constantă și pentru a vedea
cât este lucrul mecanic Să considerăm
următorul exemplu nici avem o incintă
în care avem un piston mobil piston
mobil înseamnă contact mecanic
după cum am discutat în a doua
lecție de termodinamică un contact
mecanic permite egalizare a presiunilor
dintre cele două sisteme Ce sunt
în contact prin acest contact mecanic
în cazul nostru presiunea din interior
presiunea gazului din interior
va deveni egală cu presiunea gazului
din exterior Care este atmosfera
de sigle cu presiunea atmosferică
în care este o constantă 10 la
a cincea Pascal Deci în felul acesta
pentru un piston mobil obținem
un proces izobar și acționăm asupra
pistonului și în consecință asupra
gazului din interior cu o forță
f care produce o deplasare a pistonului
pe care notăm cu Delta x Folosind
definiția din mecanică a lucrului
mecanic mai exact din prima lecție
de legi de conservare în mecanică
putem scrie că lucrul mecanic este
prin definiție produsul dintre
forță și deplasarea produsă de
acea forță care în cazul nostru
va fi egal cu produsul dintre presiune
și suprafață pentru că prin definiție
presiunea este forța pe unitatea
de suprafață Deci f egal cu p o
s iar plasarea produse de forța
noastră este Delta x Deci Delta
este Delta x în cazul nostru observăm
apoi că produsul dintre suprafața
pistonului s și Delta x este egal
cu variația de volum a gazului
din interiorul compartimentului
Deci lucrul mecanic pentru un proces
izobar este egal cu produsul dintre
presiune Care este o constantă
în acest caz și variația de volum
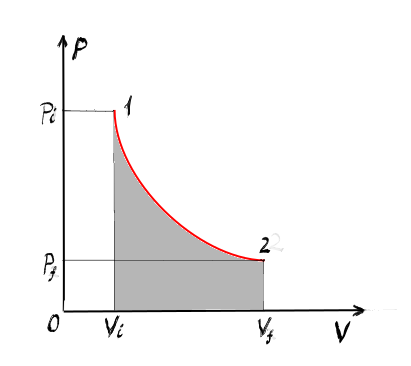
dacă Reprezentăm grafic În diagrama
presiune volum numită și diagramă
clapeyron acest proces obținem
bineînțeles o reprezentare foarte
simplă presiune este constantă
între volumul inițial și volumul
final Deci are lungimea acestui
segment este Delta b observăm că
în acest tip de grafic presiunea
ca puncție de volum lucru mecanic
Care este din nou pe cordial table
este exact aria de sub graficul
presiunii ca funcție de volum între
volumul inițial și volumul fina
această interpretare geometrică
a lucrului mecanic poate fi extinsă
la cazul general Și putem spune
că în general Este adevărat că
lucrul mecanic este aria de sub
graficul presiunii ca funcție de
volum între volumul inițial și
volumul final nu dăm o demonstrație
a acestei ecuații sau teoreme dar
ea este în general adevărat folosim
acest lucru pentru a calcula lucru
m intru în proces izoterm care
Deci are loc la temperatură constantă
știind că intru în proces izoterm
graficul întru diagramă PV este
o hiperbolă În ce avem o hiperbolă
Care este graficul unii pe season
temperatura egal constant este
constantă și De ce atunci pentru
a calcula lucrul mecanic conform
acestei interpretări geometrice
luăm volumul inițial în procesul
dat și volumul final corespunzând
stărilor inițiale și finale și
calculăm aria de sub această hiperbolă
pentru a calcula aria de sub o
hiperbolă trebuie să folosim elemente
de calcul integral care sunt făcute
la matematică în clasa a 12-a În
capitolul de analiză matematică
Deci nu vom face această demonstrație
totuși vom da bineînțeles rezultatul
final după calculul integralei
obținem că lucrul mecanic este
egal cu nu este înmulțit cu logaritm
din logaritm de raportul dintre
volumul final și volumul inițial
un ultim comentariu legat de lucru
mecanic putem observa că dacă volumul
final este mai mare decât volumul
inițial sau altfel spus deltav
a este mai mare decât 0 ținem în
toate cazurile în ambele cazuri
adică un lucru mecanic pozitiv
un lucru mecanic este pozitiv dacă
este efectuat de sistem asupra
mediului dacă volumul final Însă
este mai mic decât volumul inițial
sau Delta v e mai mic decât 0 obținem
din ambele ecuații un lucru mecanic
mai mic decât 0 în acest caz lucrul
mecanic efectuat de mediu asupra
sistemului după cum am văzut în
acest exemplu simplu în acest caz
Forța este efectuată din exterior
asupra sistemului nostru care este
gazul care duce la un volum final
mai mic decât volumul inițial și
Deci lucrul mecanic este negativ
în concluzie lucrul mecanic negativ
înseamnă lucrul mecanic efectuat
de mediu sau mediu asupra sistemului
să continuăm discuția cu noțiunea
de căldură căldura este definită
simplu ca schimbul de energie ce
are loc prin variația temperaturii
sistemului termodinamic În consecință
ecuația pentru căldură este simplă
căldura este egală cu o constantă
înmulțită cu variația de temperatură
această constantă se numește capacitate
calorică căldura se măsoară la
fel ca și lucrul mecanic în jos
unitatea de măsură este un jur
important de observat este că dacă
temperatura finală este mai mare
decât temperatura inițială în urma
unui proces în care avem loc în
care avem un transfer de energie
atunci căldura este pozitiv în
acest caz când transferul de căldură
are loc către sistem și aceasta
are sens pentru că dacă transferăm
căldură unui sistem atunci bineînțeles
temperatura lui va crește deci
temperatura finală va fi mai mare
decât cea iniția invers dacă temperatura
finală este mai mică decât temperatura
inițială adică Delta t este negativ
atunci Bineînțeles că căldura este
negativă și în acest caz avem un
transfer de căldură dinspre sistem
către mediul exterior Sau celălalt
sistem din proces unitatea de măsură
în sistemul internațional pentru
căldură așa cum am spus este un
Jur dar din motive istorice se
mai folosește și O altă unitate
de măsură numită caloria caloria
este cantitatea de căldură necesară
unui gram de apă pură ca să își
crească temperatura cu un grad
Celsius la presiune normală adică
presiune atmosferică se poate măsura
experimental bazat la sân dune
pe definiția caloriei Care este
corespondența dintre calorie și
Juli și obținem că o calorie este
egal cu egală cu un 4 virgulă 182
capacitatea calorică este o constantă
Dar ea nu este foarte des folosită
în aplicațiile practice pentru
că nu este o constantă de material
adică nu iau o valoare fixă pentru
o substanță dată în locul ei se
folosesc cel mai des așa numiții
coeficienți calorici primul este
căldura specifică notată cu c mic
definită ca raportul dintre transferul
de căldură din proces și produsul
dintre masă și variația de temperatură
Evident observăm că capacitatea
calorică va fi egală cu masa ori
căldura specifică căldura specifică
are proprietatea importantă că
are o valoare fixă pentru o substanță
dată după cum vom vedea în curând
o altă variație acestui coeficient
caloric este așa numită căldură
specifică molară în care în loc
să împărțit la masa sistemului
împărțind la numărul de moli adică
tot la o măsură a cantității de
substanță din sistem o variație
suplimentară a definiția acestor
coeficienți calorici este sunt
așa numiții coeficienți calorici
izobari de ce avem căldura specifică
izobară Care este căldura specifică
într un proces ce are loc la presiune
constantă și căldura specifică
molară izobară Care este căldura
specifică molară folosind numărul
de moli în loc de masă intru în
proces ce are loc la presiune constantă
și evident vom avea echivalentul
vom defini echivalentele izocore
Deci căldura specifică izocoră
va fi căldura specifică la volum
constant și căldura specifică molară
izocoră va fi căldura specifică
molară la volum constant un ultim
parametru care se folosește este
aceea așa numitul exponent adiabatic
notat cu gama și definit ca raportul
dintre căldura specifică sau căldura
specifică molară oricare dintre
ele vreți să folosiți același lucru
dar între căldura specifică izobară
și cea izocor Deci aceasta este
definiția exponentului adiabatic
se pot se pot măsura experimental
toți acești parametri și acest
tabel arată pentru diferite gaze
cei trei parametri căldura specifică
în molară izobară căldura specifică
molară izocoră și exponentul adiabatic
gama foarte interesant de observat
în acest tabel de Valori experimentale
este că le putem grupa în funcție
de valorile obținute în în trei
grupe aceste gaze Distrigaz argon
heliu și neon sunt monoatomice
sunt gaze Mono atomice următoarele
trei gaze după cum Este evident
și anume gazele de oxigen hidrogen
și azot sunt biatomice molecula
este formată din doi atomi iar
ultimul gaz pe care îl arătăm în
acest tabel este triatomic adică
molecula are trei atomi ce se poate
observa putin dune la valorile
acestor parametri Spre exemplu
la exponentul adiabatic gama este
că pentru aceea structura atomică
a moleculei valorile lui gama după
cum și valorile celorlalte parametri
sunt foarte apropiate între ele
par să fie date numai de structura
moleculei întradevăr în fizica
statistică se demonstrează că exponentul
adiabatic gama este egal cu a plus
2 împărțit la ai unde este numărul
de grade de libertate am discutat
despre numărul de grade de libertate
e și despre legătura dintre teoria
cinetico moleculară și fizica statistică
în cele două precedente despre
teorie cinetico molecular tot din
cadrul modulului de termodinamică
vezi ce demonstrează că gama are
această valoare și ca și comentarii
În primul rând observăm că gama
este mai mare decât unul întotdeauna
ceea ce înseamnă că coeficienții
că Căldura specifică izobară este
întotdeauna mai mare decât cea
izocoră asta înseamnă că procesul
izobar este mai eficient în transferul
de căldură decât cel izocor iar
o altă concluzie importantă și
interesantă Este că putem calcula
gama pentru diferite structuri
Spre exemplu II numărul de grade
de libertate pentru orice moleculă
monoatomic că este egal cu 3 corespunzând
celor trei grade de translație
din o am discutat aceste lucruri
în lecțiile de teorie cinetică
moleculară Deci un gaz monoatomic
va avea egal cu 3 introducând valoarea
lui în formula pentru gama obținem
întradevăr că gama este 5 împărțit
la trei adică 1 întradevăr ceea
ce am obținut experimental pentru
molecule diatomice e este luat
ca egal cu 5 pentru că pe lângă
cele trei grade de translație vom
mai avea și două grade de rotații
molecula diatomica are și o mișcare
de rotație întradevăr gama obținut
va fi egal atunci cu 7 împărțit
la 5 Care este 1 și așa mai departe
Deci întradevăr putem obține Teoretic
valorile măsurate pentru aceste
pentru acești parametri unul tema
lucru pe care îl menționăm este
că se introduce noțiunea de proces
adiabatic Care este un proces ce
are loc fără transfer de energie
Deci prin definiție un proces adiabatic
q este egal cu 0 se poate demonstra
noi nu vom face pentru că din nou
implică noțiuni de calcul integral
de ce avem nevoie de o matematică
mai avansată dar se poate demonstra
că pentru un proces adiabatic ecuația
fundamentală este următoarea pe
ori volumul la puterea gama unde
gama este acest exponent adiabatic
este o constantă aceasta se numește
ecuația Pustan și cu blând o cu
ecuația generală a gazelor pev
egal cu 1 x 3 care vinde cest rămâne
cu rămâne valabilă putem extrage
și alte expresii pentru ecuația
pawson înlocuim Spre exemplu presiunea
cu temperatura și vom obține că
temperatura ori volumul la gama
minus 1 la puterea 2 minus 1 este
o Constanța