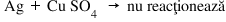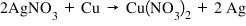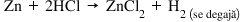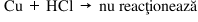Seria activităţii metalelor
Partajeaza in Google Classroom

Transcript
este trecută am vorbit despre procesele
de oxidare și reducere care împreună
formează o reacție amintim că oxidarea
înseamnă cedare de electroni și
creșterea numărului de oxidare
a speciei care se oxidează iar
reducerea înseamnă acceptare de
electroni și scăderea numărului
de oxidare a speciei care se reduce
Ce lucruri trebuie să se întâmple
pentru ca o reacție reduc să aibă
loc Ica electronice de la o specie
la alta adică să aibă loc un transfer
de electroni dacă asta se întâmplă
indiferent de tipul speciilor chimice
implicate atuncea chiar reacție
este clasificat ca fiind o reacție
raton exemplu simplu dar foarte
important de reacție redox este
reacția care are loc dacă introducem
o bucată de zi pentru o soluție
de sulfat de suprafața zincului
va apărea un strat de cupru iar
o parte din NATO mii de zi se vor
dizolva sub formă de Ion de zinc
plus doi deci atomi de zinc dat
electroni și sau oxidat la ionese
in plus doi n plus pentru că Ioni
de cupru și 2 din soluția de spate
cu pluta transformator atomi de
cupru prin acceptare de electroni
spunem că ionii de cupru sau redis
această reacție redox ar putea
părea interesantă Însă este chiar
reacții la care stă la baza apariției
sistemelor de comunicații moderne
ce se întâmplă de fapt în reacție
vedem că prin transferul de electroni
care are loc din cur Înlocuiește
cuplul din sulfatul de cupru aceasta
se numește reacție de substituție
sau reacție de simplă înlocuire
explicația înlocuirii cuprului
cu zincul reactivității metalelor
vedem în această serie când zincul
este un metal active iar cuprul
este un metal mai puțina asta înseamnă
că zincul poate scoate cuprul din
soluție astfel cu ajutorul acestei
serii putem prezice produșii de
reacție fără să fie neapărat nevoie
să facem experimentul în laborator
hidrogenul apare în serie ca termen
de comparație pentru orientalilor
Haideți să vedem ce se întâmplă
dacă adăugăm o bucată de argint
în soluției de sulfat de cupru
ne uităm în serie afinității metalelor
și vedem că argintul este chiar
mai departe de intro gen față de
cupru este și mai puțin activi
decât cupru și astfel ne dăm seama
că argintul nu poate substitui
cucul deci de fapt în acest caz
nu există produs de scheme dacă
între o soluție de nitrat de argint
introducem un fir de cupru cuprul
va putea înlocui argintul din soluție
pentru că după cum știm elementelor
cubul este mai activ decât argint
astfel putem prezice că produși
aceste reacții sunt pătratul de
cupru și precipitatul de argint
ca să ne convingem putem face experimentul
în laborator iată ce se va întâmpla
pe suprafața sârmei de cupru va
apărea un strat de argint Sony
deci atomi de cupru sau și dați
la Ion de cupru 2 plus iar ionii
de argint plus sau redus la atomi
de argint se metalelor ne mai spune
și cum reacționează acestea cu
apa sau cu acizii de exemplu toate
Metalele de aici și până la și
trojan înlocuiesc dacă peste eprubetă
cu pulbere de zinc tournament clorhidric
vom observa că se degajă niște
bule de gaz atunci când îl apropie
muncim brita prins de eprubetă
aceste bule de gaz se vor aprinde
și vor arde cu o pocnitură acesta
este Deci dro genul care se degajă
din din cu la luat locul in genului
și astfel sa format clorura de
zi la fel se întâmplă și în reacția
aluminiului cu acidul clorhidric
hidrogenul se degajă iar aluminiu
formează clorura de aluminiu și
coeficienții stoechiometrice ai
reacție se obțin trei molecule
de hidrogen Deci coeficientul acidului
clorhidric va fi 6 astfel la clorura
de aluminiu avem coeficientul 2:02
la aluminiu imediat vom vorbi și
despre cum am stabilit coeficienții
stoechiometrici aceste reacții
Pe de altă parte cuprul fiind un
metal cu o reactivitate redusă
după înlocuiești gros genul din
acidul clorhidric Uite această
reacție are produs de reacție la
fel nici argintul platina sau aurul
nu vor înlocui hidrogenul din clasă
dar vedem că se reactivității metalelor
poate fi folosită pentru a prezice
comportamentul metalelor în anumite
reacții explicația e foarte simplă
creativitatea metalelor se datorează
diferențele dintre instabilitate
a configurației electronice a metalului
Unde se află sub formă de atomi
față de stabilitatea configurației
când Metalul se găsește sub formă
de exemplu potasiul are un singur
electron în stratul electronică
exterior de care ar trebui să scape
pentru a ajunge la o configurație
stabilă de gaze Metalele prețioase
din blocul de precum argintul latină
palagio aurul Deci aceste metale
nu pot forma aa structură electronice
mai stabile decât ruptura din starea
lor elementară Doar prin cedarea
cândva electroni Metalele care
trebuie să piardă un singur electron
pentru a forma Ion stadion sunt
cu bune reactive decât cele care
ar trebui să cedezi mai mulți electroni
de aceea Metalele din grupa întâi
principală sunt cele mai reactive
dacă vă mai amintiți am mai discutat
despre asta chiar eu în capitolul
dedicat tabelul periodic al elementelor