Structura compuşilor organici – formule moleculare şi formule structurale
Partajeaza in Google Classroom

Transcript
care sunt făcute numărate lucrurilor
nostru și uleiul pe care folosim
la cartofii prăjiți și gazul Metan
sunt toate substanțe formate din
molecule organice proprietăți fizice
și chimice foarte diferite legate
de structura compușilor organici
că vreau să vedem cum putem folosi
substanțele organice folosul nostru
e că vrem să înțelegem mâncarea
lume dintre ele trebuie să ne ferim
este esențial să avem o cunoaștere
cât mai detaliată a Proprietăților
substanțelor organice și în consecință
esențial să cunoaștem chimie organică
este mai precis o chimie a structurilor
molecular noțiunea de structură
chimică se referă la natura atomilor
din molecula la numărul lor și
la felul în care sunt legați în
acea molecule putem stabili Braun
cordani parcurgând mai multe etape
prima etapă este analiza elementară
Ce presupune de fapt două tipuri
de analize și anume analizei calitative
și cantitative la care sunt supuși
compuși organici analiza calitativă
Stabilește speciile de atomi care
le cobori substanță analizată iar
analiza cantitativa arată numărul
de atomi din fiecare specie adică
Stabilește compoziția substanțelor
stabili natura atomilor adică pentru
a realiza analiza elementară calitativă
se aplică metoda artei gazele rezultate
din arderea sunt analizate unor
reacții reacții elementele organogene
din compușii organici sunt transformate
în compuși ce pot fi Determinați
cantitatea Ce determină mai pleci
din datele obținute după această
analiză elementară se determină
prin calcul concentrația procentuală
a fiecărui element din comuna procentuală
formulă ce indică masa fiecărui
element din 100 de g de substanță
analizată dacă suma procentelor
este mai mică de sută la sută atunci
diferența se atribuie oxigenului
care se analizează mai greu de
exemplu prin arderea a 0 distanță
organică obtinem 0 40 g de carbon
și 0 70g de aceste date putem determina
formula procentuală a substanței
mai întâi calculăm masa molară
a dioxidului de carbon obținem
44 G pe Mol și masa molară a apei
Care este 18 G pe Mol în continuare
aplicăm regula de 354 de g de dioxid
de carbon Avem 12 dame de carbon
și astfel prin regula de trei simpla
Câte grame de carbon se găsesc
în 0 40 g de carbon Care este obținut
prin arderea substanței organice
în urma efectuării calculului obținem
0 la fel Știind că în 18 g de apă
Avem două grame de hidrogen iar
prin regula de trei simpla aflăm
Câte grame de hidrogen Se găsesc
în ce an a 0 70 g de apă obținute
prin targ obținem 0 G ce Aplicând
regula de trei simple aflăm concentrația
procentuală a carbonului și hidrogenului
în compusul organic pe care îl
analiză a aflat până acum că în
0 30 de grame de substanță avem
0 C G Caravan 5 0 hidrogen în 100
de g de substanță b procent de
carbon și unul de hidrogen efectuăm
calculele și obține 52 la sută carbon
și 13 4% hidrogen în total avem
un procent de 65 la sută Așadar
121 adică 34 și 9% astfel au obținut
compoziția boală care arată că
în 100 g substanță organică analizată
se află 52 virgulă 17 0 G hidrogen
și 34 zeci și 9 g oxigen sau arată
că raportul de masă în care se
combină elementele componente este
acesta aduci la porci de masa poate
fi transformat în raport dintre
numărul de moli de a astfel putea
determina formula brută din compoziția
procentuală formula brută arată
o natura atomilor și raportul în
care se găsesc în moleculă exprimat
prin numere întregi pentru a afla
numărul de atomi componenți din
împărțim procentul fiecărui element
la masa lui aduc pentru carbonat
vei învinge și 2 g supra 12 grame
pe bucă egal cu 4 și 4 moli de atomi
de carbon pentru hidrogen avem
13 4 supra 1 egal cu 13 de hidrogen
iar pentru oxigenare 34 zeci și
9 supra 16 egal cu 2 moli împărțind
toate rezultatele la cel mai mic
dintre ele care în cazul nostru
este 2 putem Estima mai simplu raportul
dintre numărul de moli de atomi
din fiecare element component în
cazul carbonului am obținut 2 respectiv
6 în cazul hidrogenului și unul
în cazul raportul atomic în care
se combină elementele componente
este același cu raportul între
numărul de moli De atomi ce anume
acesta pornesc pune că la doi atomi
de carbon avem 6 atomi de hidrogen
și un atom de tot conform acestui
raport tu de scrie formula brută
carbon 2 totul de nori formula
brută îmi arată că în molecula
substanței organice analizate sărbători
mai mulți atomi din fiecare element
Indică raportul la formula moleculară
este de fapt un multiplu întreg
al formulei brute se poate determina
Din formula brută dacă se cunoaște
masa molară a substanței în cazul
exemplului nostru se cunoaște că
masa molară este egală cu 46 de
g pe Mol această valoare valoarea
lui Deci masa molară a compușilor
cu formula carbon 2 drogen 6 oxigen
de Nord este egală cu 2 ori masa
atomică a carbonului masa atomică
a oxigenului obținem că 46 este
egal cu n ori 46 astfel rezultă
că valoarea lui n este acest fel
am terminat că formula moleculară
este carbon doi hidrogeni 6 oxigen
dacă nu se cunoaște masa molară
aceasta poate fi determinată Cunoscând
alte date despre substanță analizată
dacă precum densitatea sau densitatea
relativă a vaporilor substanței
Mă îndrept apele pe care le parcurgem
pentru a determina formula moleculară
Din formula procentuală sau din
aportul de masă sunt următoarele
mai întâi împărțim procentul de
masă sau masa fiecărui element
la masa atomică a venit în continuare
împărți rezultatele la cel mai
mic dintre ele astfel stabilit
iar din formula brută determinăm
valoarea lui n Și stabilim formula
moleculară a sta Cunoscând Masa
moleculară sau ai dat despre substanță
analizată după stabilirea formula
structurală Precizează modul de
legare al atomilor în moleculă
mai pentru a precizați structura
unei substanțe organice trebuie
să cunoaștem următoarele sau aranjamentul
atomilor în moleculă tipul legăturilor
covalente dintre aten simplă dublă
sau triplă și nu în ultimul rând
orientare atomilor spațiu Toate
aceste aspectele ale structurii
unei molecule organice sunt indicate
de Formula structurală determinarea
structurii chimice Ioi dar pe Complexul
utilizează atât metode de chimice
cât și tot de fizice de investigație
Metodele fizice sunt mai rapid
decât investigare a Proprietăților
chimice ale putem folosi mai multe
tipuri de formule structurale fiecare
dintre ele indicând întruna numește
structura moleculei organici astfel
în aceste două exemple cu valențele
orientate în planul ecranului sunt
reprezentate prin mini obișnuite
covalentele orientate spre noi
spre a privitor sunt reprezentate
cu linii îngroșate iar covalentele
orientate în planul opus 9 a privitorului
sunt reprezentate cu linii întrerupte
în reprezentarea tuturor acestora
aspecte structurale este laborioasă
mai ales în cazul moleculelor formate
din număr mare de atomi de cele
mai multe ori insuficiență Indică
doar succesiunea atomilor în moleculă
și natura legăturilor dintre ei
iha cel mai frecvent utilizata
formulele de proiectie restricție
care se mai numesc și formule plane
Aceasta este o formulă de proiecție
iar aceasta este formula plană
a aceluiași compus observăm că
în formulele plane nu mai sunt
indicate legăturile covalente hidrogen
de metal care sunt întotdeauna
legături simple și de asemenea
trebuie să reținem că numărul cu
valențelor indicate plus numărul
atomilor de hidrogen este 4 pentru
care bun 3 pentru azot și 2 pentru
oxigen prezent lui Haideți să completăm
cu atomi de hidrogen aceste două
formule plane acest atom de carbon
are trei covalente Deci aici lipsește
un singur atom de hidrogen următorul
atom de carbon are patru covalente
Deci mai are nevoie de nici un
atom de hidrogen și următorul carbon
la fel are toate cele patru componenți
ocupate atomi de oxigen are două
covalente însă celălalt atomi de
oxigen are numai una asta înseamnă
că x este un atom de hidrogen acest
atom de carbon are trei atomi de
hidrogen următorul are doi atomi
de hidrogen vedem totul are două
cu valențe de cei mai lipsește
un singur atom de hidrogen Iar
următorul atom de carbon are trei
atomi de hidrogen unei formule
moleculare îi pot corespunde mai
multe formule structurale să revenim
la exemplul nostru de mai devreme
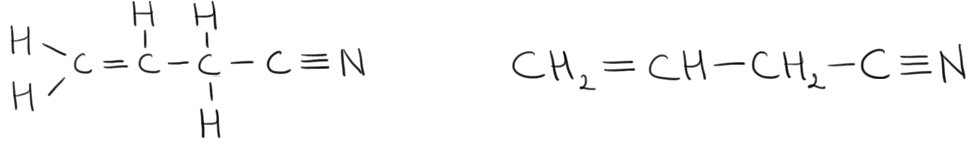
pentru formula moleculară carbon
doi urgent 6 oxigen puteți primi
două formule structurale diferite
formule structurale corespund unor
compuși foarte diferiți compuși
organici care au în moleculă același
timp și același număr de atomi
adică aceeași moleculară dar în
care aceștia domnul sunt legat
și în același fel având astfel
structuri diferite se numesc izomerii
acum două persoane care au același
număr de piese lego de aceleași
culori se folosesc pentru a construi
în două modele diferite în cazuri
din organism somerii se clasifică
în două mari categorii izomeri
de constituție izomeri de constituție
pot fi izomeri de catenă și de
poziție sau pot fi izomeri de funcțiune
care chiar cazul exemplului de
mai devreme Așadar vedem că izomeri
de constituție inspiră prin modul
de legare al atomilor proprietățile
fizice și chimice ale Americii
foarte diferite izomeri sterici
geometrici izomerii geometrici
sunt de două ori izomere diferă
prin dispunerea substituenților
atomilor de carbon dublul egal
acestui atom de introduci atomi
diferă prin dispunerea acestor
substituenți față de planul legăturii
din legătura după Așadar izomeri
sterici au în spații diferite ale
atomilor sau al grupelor de proprietățile
fizice și chimice diferă mai puține
în acest caz cu această lecție
încheie capitolele de introducere
organică acum Avem necesare pentru
a începe studiul diferitelor clasei
de compuși organici așa dar data
viitoare vom vorbi despre el ca