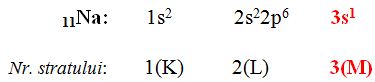Tabelul periodic – grupe şi perioade
Tag-uri
Partajeaza in Google Classroom

Transcript
o dată cu descoperirea tot mai
multor elemente chimice apărut
și nevoia de ala clasifica există
foarte multe încercări de sistematizare
elementelor în sabia în 1869 Chimistului
Rus Dimitri Mendeleev a făcut una
dintre cele mai mari descoperiri
ale omenirii observat că elementele
posti clasificate după o anume
legea care a denumit o lege a periodicității
inițial când încă nu se știa tot
ce știm noi astăzi despre structura
atomului această lege a periodicității
sunat Cam așa proprietățile fizice
și chimice ale elementelor sunt
între o dependență periodică de
masele lor atomice aceasta este
ideea de la care a pornit mendelev
când a creat tabelul periodic așa
dar și în această lecție vom vorbi
tot despre structura atomilor și
despre configurațiile electronice
însă de data aceasta vom face referire
la legătura dintre structură și
poziția elementelor chimice în
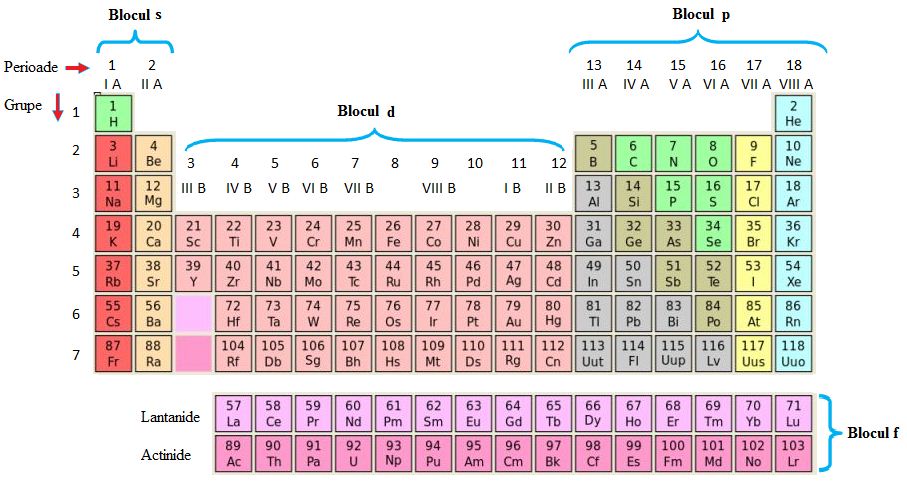
tabelul periodic tabelul periodic
a împărțit în grupe și perioade
șirul orizontale sunt perioadele
iar coloanele verticale sunt grupele
Deci acest șir orizontal este o
perioadă iar această coloană verticală
este o grupă poziția unui element
chimic în tabelul periodic depinde
de structura atomului său Cică
un element e caracterizat prin
masa atomică a și prin numărul
atomic z după cum ai spus iar în
primele lecții numărul atomic z
adică numărul total al protonilor
din nucleu Indică poziția unui
element în tabel Deci 10 este numărul
de ordine al elementului 10 numește
număr de ordine pentru elementele
chimice sunt ordonate în perioade
în ordinea în care crește fiecare
element are cu un procent mai mult
decât elementul dinaintea lui Și
de aici și cu un electroni mai
mult electron care se numește electroni
distinctivi să ne reamintim și
că întrun atom care are pere total
o sarcină electrică neutră numărul
protonilor din nucleu este egal
cu numărul electronilor din înveliș
și putem vedea și în tabel numărul
atomic z al unui element este mai
mare cu 1 decât numărul atomic
al elementului precedent numărul
perioadei Indică de fapt numărul
straturilor ocupate complet sau
parțial cu electroni și mai Indică
și numărul stratul exterior din
învelișul electronic adică al stratului
în care se află electronii de valență
ai atomului de exemplu elementul
sodiu din perioada a treia că vinde
în perioada a treia sodiul are
trei straturi ocupate cu electroni
adică stratul 1 sau ca stratul
2 sau a și 3 sau Haideți să și
scrie în configurația electronică
a sodiului 11 electroni învelișul
iar în primul strat avem o orbitalul
1s cu doi electroni apoi în al
doilea strat Avem doi 10 doi și
doi pe cu șase electroni iar în
stratul al treilea sodiul are un
singur electron în orbitalul 3S
vedem Așadar că numărul a ultimului
strat este și numărul perioadei
vedem în tabelul periodic că prima
perioadă adică aceasta este cea
mai scurtă are numai două elemente
hidrogenul cu un singur electron
și heliul cu doi electroni configurația
heliului este 1 S2 de stau cu pat
complet primul strat electro urmează
perioada a doua Unde în cazul litrului
care are trei electroni începe
ocupare a celui de al doilea strat
electronic Deci configurația litiului
este 1 s22 S1 și perioadele 2 și
3 ale tabelului sunt perioade scurte
Ele au numai câte opt elemente
perioada a doua se încheie cu neonul
care e la fel ca și heliul este
un gaz rar neonul are pe ultimul
strat o structură stabilă de octet
Deci configurația lui este 1 s22
s22 pe 6 acum stratul 2 este complet
ocupat cu electroni fiecare perioadă
se încheie un element pentru care
ultimul strat electronic este complet
ocupat de ce acestea sunt gazele
rare care sunt foarte stabile datorită
structurii acesteia de 8 electroni
pe ultimul perioadele 4 5 și 6
sunt perioade lungi începând cu
perioada a patra începe ocupare
a orbitalilor de tip de când le
amintim că energia necesară pentru
ocupare a substratului 3D este
mai mare decât energia necesară
pentru ocuparea substratului 4s
Deci ordinea de ocupare a straturilor
cu electroni este următoarea 4s
3D și patru pe Așadar începând
cu perioada a patra după elementul
calciu va începe ocuparea cu electroni
a substratului 3D cinci rânduri
se astfel prima serie de metale
tranzitionale de acestea completează
substratul 3D de la 3:00 de unul
către trei de 10 rânduri amintiri
și configurația electronică a unui
element din perioada a patra vom
lua exemplu titanului care are
22 de electroni în învelișul are
primul strat ocupat complet al
doilea strat la fel ocupat complet
doi doi doi pe șase al treilea
strat trăiesc 2 3 pe 6 și apoi
se ocupă substratul 4 rest 2 din
statul cu numărul 4 și abia apoi
sunt ocupați cu electroni și orbitali
din substratul 3D mai putem scrie
configurația titanului și în funcție
de configurația gazului rar care
a încheiat perioada a treia Deci
în funcție de configurația argon
ce avem configurația argonului
3 D24 S2 deci de aici și până aici
este configurația arcul să ne reamintim
și că aceasta este ordinea de ocupare
cu electroni care scoate în evidență
electronul distinctiv iar aceasta
este configurația electronică pe
care scoate mâner intenție lectron
II de valență adică electroni aflați
în stratul exterior cel mai îndepărtat
din perioada a cincea situația
este similară cu perioada a patra
așa cum în perioada a patra se
completează cu electroni substratul
3D în perioada a cincea se completează
substratul 4 pentru ca perioadele
6:07 să nu fie mai lungi decât
celelalte perioade din tabel lantanidele
și actinidele sunt scrise sub tabelul
periodic în două rânduri datele
se mai numesc și pământuri rare
și au proprietăți foarte asemănătoare
unele cu altele sunt denumite după
elementul lantanidele sunt elemente
radioactive și la fel au proprietăți
minare unele cu altele au fost
denumite după elementul actiniu
care le precedă în tabelul periodic
în cazul lantanidelor și activelor
electroni desene cu portal din
substratul 4 f respectiv din substratul
cincea așa dar știi până acum că
numărul perioadei Indică numărul
de straturi electronice ocupate
parțial sau complet de electroni
dar și numărul stratului exterior
stratul exterior se mai numește
și strat de valență având în vedere
acest strat se află electronii
de valență și tot despre perioade
mai știm că fiecare începe cu un
element care are în stratul exterior
un singur electron și se termină
cu un element care are stratul
exterior 8 electroni adică cu un
gajar Haide să ne uităm și la grupele
tabelului periodic cele opt grupe
sunt grupe mari și grupei mici
grupele mari sunt cele de la marginea
tabelului și se numesc grupe principale
iar grupele mici care conțin câte
trei patru elemente se găsesc aici
la mijlocul tabelului acestea sunt
grupele secundare grupele principale
sunt numerotate cu cifre arabe
în felul următor aceasta este grupa
1 grupa 2 și acestea sunt grupele
13 14 Și până la grupa cea mai
suna odată și cu cifre romane urmată
de litera A mare Deci grupa 1a
2a 3a și tot așa până la grupa
A 8-a La fel și grupele secundare
sunt numerotate fie cu cifre arabe
3 4 5 6 și până la 12:00 fie cu
cifre romane urmat de litera B
mare Deci grupa A 3-a B4 B5 B6
7b acestea toate reprezintă grupa
8b au fost grupate astfel probabil
datorită anumitor proprietăți milă
are ale acestui metal iar aceasta
este grupa 1 și grupa 2 acestea
sunt elementele tranziționale elementele
care formează o grupă au în comun
același număr de electroni de valență
grupa 1a este grupa metalelor alcaline
care au toate câte un singur electron
de valent hidrogenul de și face
parte din grupa 1 principală nu
este un metal alcalin se afla Aici
Doar datorită configurației sale
electronice fost grupa a doua principală
care este grupa metalelor alcalină
pământul sa toate e câte doi electroni
de valență petalele din grupele
secundare au toate câte doi electroni
de valență chiar dacă electronul
distinctiv upă umflat interior
electronii de valență sunt cei
din stratul exterior adică stratul
care dă și numărul perioadei și
în cazul tuturor acestor grupe
secundare sunt câte doi electroni
de valență urmează celelalte grupe
principale care au toate numărul
de electroni de valență egal cu
un numărul grupei notate cu cifre
romane adică trei electroni 4 electroni
5 6 7 și 8 electroni de valență
o altă modalitate de a calcula
valență acestor pupici pare i se
dea scădea din numărul grupei notat
cu cifre arabe cifra 10 10 fiind
numărul grupelor secundare elementele
din grupa șaptea principală se
numesc halogeni iar elementele
din grupa a opta principală care
încheie perioadele se numesc gaze
nobile sau gaze după cum am datorita
configurațiilor electronice foarte
stabile gazele rare a o reactivitate
foarte foarte redusă elementele
chimice se mai talul în care se
află electronul distinctiv după
cum am mai precizat și intră lecție
trecută elementele care au electronul
distinctiv între un orbitali s
urmează locul în locul s sunt elementele
din grupele principale 1 a și 2-a
în blocul pe se găsesc elementele
din grupele principale de la a3a
la 8 a acestei electronul distinctiv
întru un orbital pe al ultimului
strat excepție face heliu care
deși are configurația 1 S2 se află
în blocul pe datorită proprietăților
sale foarte similare cu celelalte
gaze rare blocul de se găsesc elementele
din grupele se dare de la grupa
a treia la grupa 12 acestei grupe
electronul distinctiv ocupă un
orbital al atenției Alpin ultimului
strat Deci în cazul unui strat
al unui element dintre o perioadă
a electronul distinctiv se află
în substratul in minus unu D așa
dar dacă ne aflăm în perioada a
patra în blocul de se află elementele
care au substratul 3D în curs de
completare iar în cazul perioadă
a 5-a a se afle elementele care
au substratul 4 de în curs de completare
în blocul f sunt elementele care
au electronul distinctiv întrun
orbitali s l antepenultimul lui
strat adică în cazul unei perioade
in vorbind substratul n minus 2x
după cum am spus mai devreme în
cazul perioadelor a șasea și așa
Ia lantanidele și actinidele au
substraturile 4f 5f curs de completare
elementele de tip d și F se numesc
elemente tradiționale indiene fac
trecerea între elementele de tip
s și cele de tip practicile de
sparg blocurile s și așa dar am
stabilit în această lecție cum
stă treaba cu grupele și perioadele
tabelului Terios să vedem acum
și la ce ne ajută să avem toate
aceste informații foarte important
să ținem cont întotdeauna că atomi
și doresc cu toții să ajungă la
configurație stabilă de octet sau
de duble În două câte opt electroni
sau doi electroni pe ultimul strat
exact ca gazele rare știind că
acest lucru și știind și numărul
de electroni de valență al fiecărui
atom din tabel prezice anumite
comportamente și proprietăți ale
elementelor să luăm Spre exemplu
grupa halogenilor care au șapte
electroni în stratul de valență
halogenilor la mai lipsește un
singur electroni pentru a ajunge
la configurația stabilă de octet
De cine își doresc tare tare mult
acest electroni să ne uităm acum
și la Metalele alcaline care au
un singur electron în stratul de
valență elemente Trebuie doar să
scape de acest electroni și voi
ajunge și el e la configurațiile
de octet respectiv de dublat în
cazul litrului De ce elementele
alcaline doresc tare mult să scape
de aceast Electronică Dacă vom
pune împreună un halogen cu un
metal alcalin acestea vor reacționa
Cu siguranță de citind aceste lucruri
despre structura învelișului electronic
putem să ne explicăm anumite proprietăți
ale elementelor în lecțiile viitoare
vom discuta mai detaliat corelația
dintre proprietățile elementelor
și poziția acestora în tabelul
periodic