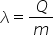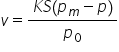Transformări de stări de agregare. Vaporizarea, fierberea. Căldură latentă.
Tag-uri
Partajeaza in Google Classroom

Transcript
În ciuda 14 al lecției de termodinamică
vom discuta despre transformările
stărilor de agregare în particular
despre vaporizare și fierbere să
introducem în testele de agregare
ele sunt întâlnite în experiența
noastră cotidiană și sunt următoarele
solidă lichidă și gazoasă acestea
sunt cele trei principale stări
de agregare despre care vom discuta
în termodinamică există o a patra
stare de agregare numită plasmă
Care este starea materiei din soare
sau din stele frecvent în această
imagine vedeți cele trei stări
de agregare ale apei și anume starea
solidă sub forma acestor bucăți
de gheață starea lichidă în care
plutesc bucățile de gheață și starea
de vapori care este la suprafața
lichidului această clasificare
a stărilor de agregare solidă lichidă
și gazoasă se face pe baza raportului
dintre energia cinetică medie a
moleculelor din substanță și adâncimea
gropii de potențial a interacției
dintre aceste molecule despre aceste
această clasificare și discuții
asociată clasificării stărilor
de agregare sa discutat în cea
de a doua lecție de teorie cinetică
moleculară pe care vă invit să
o revizuiți se numește faza unui
sistem o regiune întru anumită
stare de agregare una din aceasta
trei separată de celelalte faze
ale sistemului prin suprafețe clar
delimitate în particular în această
imagine putem identifica ușor suprafețele
de separare dintre lichid apă lichidă
solidă și apă în stare de vapori
acestea sunt în consecință cele
trei faze ale acestui sistem echilibru
de fază între fazele aceleiași
substanțe aflate în contact se
obține atunci când masa fiecărei
faze este constantă în timp în
alte cuvinte atunci când putem
spune că nu mai există transfer
de substanță între fazele sistemului
Spre exemplu când nu mai există
transfer de substanță între lichid
și solid lichid și gheață În exemplul
nostru am discutat despre vapori
vapori de apă în cazul acestei
imagini vaporii nu sunt o stare
de agregare în sine Deci vaporii
nu sunt nici lichid nici gazos
ca substanță ca stare de agregare
substanței ci sunt mai degrabă
o stare de tranziție între fazele
lichidă și gazoasă Eee vaporii
au atât proprietăți lichide Spre
exemplu sunt vizibili substanțele
în stare de agregare gazoasă nu
sunt vizibile dar și la prieteni
si fice gazului Spre exemplu sunt
moleculele de vapor sunt libere
nu există forțe de interacție semnificativă
între ele spre și în consecință
se expandează în volum foarte rapid
ceea ce este o proprietate specifică
gazelor deci vaporii sunt o stare
tranziție între lichide și gaze
și în final transformările de stare
de agregare în mod Evident se definesc
ca trecerile substanței dintr o
stare de agregare în tot Deci o
transformare de stare de agregare
ar fi tranziția sau transformarea
apei din lichid de încetează sau
solid vaporizarea este tranziția
lichidului în stare de gaz și în
particular vaporii sunt sunt stare
intermediară a substanței pe care
o găsim în timpul acestei transformări
experimental sa măsurat viteza
de vaporizare a unui lichid și
sau obținut această ecuație în
care k este o constantă ce depinde
de temperatura și viteza atmosferei
de deasupra lichidului s este suprafața
de contact a lichidului cu atmosfera
Deci dacă avem Spre exemplu un
recipient în care se află un lichid
și deasupra lichidului vom avea
o atmosferă bineînțeles ca Constanta
ca depinde numai de proprietățile
atmosferei s este suprafața de
contact dintre lichid și atmosfera
de deasupra lui pe zero este presiunea
atmosferică avem pe zi pe este
presiunea vaporilor care se formează
deasupra lichidului în timpul vaporizarii
Deci deasupra lichidului vom vedea
această stare de tranziție numită
vapori pe care am văzut o schimb
imaginea precedentă și P este presiunea
lor iar pe m este presiunea maximă
a vaporilor saturat si Ce sunt
apără saturați vapori saturați
sunt vaporii aflați în echilibru
de fază cu lichidul din care provin
echilibrul de fază reamintesc este
starea în care nu mai are loc schimburi
de substanță între două față Deci
vapori saturați sunt vaporii care
nu mai comunică cu lichidul prin
în sensul ala schimbului de substanță
presiunea va sustin este presiunea
maximă la care pot ajunge vaporii
și ea depinde mari de temperatura
lichidului și de natura lichidului
nu depind Spre exemplu de proprietățile
atmosferice 0 sau temperatura și
viteza atmosferei din această ecuație
putem trage câteva concluzii importante
prima este că vaporizarea încetează
când vaporii mai exact presiunea
lor ajunge egală cu presiunea maximă
ceea ce e un alt fel de a spune
că va porii devin saturați Deci
viteza egal cu 0 De vaporizare
ce Ce înseamnă că vaporizare încet
De asemeni putem observa că vaporizarea
în vid este instantanee prin vaporizare
în Vidin înțelegem că recipientul
nostru cu lichid este închis într
o incintă în care cremă starea
de vite sau mai specific o stare
în care presiunea atmosferei este
extrem de căzută în scăzută aproape
de Acel ce scazi bineînțeles pe
zero este zero și Deci din formulă
vedem că viteza devin infinită
Deci polizarea închide instantanee
vaporizarea în atmosferă limitată
alint dar încetează la aceeași
presiune maximă în atmosferă limitată
limitată înseamnă faptul că lichidul
care se va porni zează se află
în incintă dar de data aceasta
nu avem vinde în incintă ce anumite
atmosfera în acest caz nu mai avem
bineînțeles o viteză infinită de
vaporizare și o anumită valoare
finită Dar putem spune din formulă
că deși vaporizarea e mai lentă
încetare a va avea loc în același
moment și anume când vapori saturați
ating această valoare maxim și
în fine numim evaporare vaporizarea
în atmosferă nelimitat adică în
care nu există o astfel de incintă
are lichidul să se evapore sau
să se va vaporizează sau dacă ea
există este mult mai mare în volum
decât volumul lichidului în acest
caz va polizarea nu se poate încheia
pentru că va porii Nu pot atinge
valoarea maximă a presiunii Nu
pot deveni saturat și deci în consecință
evaporarea definită în acest fel
este o vaporizare care nu poate
înceta își va continua până când
tot volumul de lichid se evaporă
fierberea este tipul particular
de vaporizare ce are loc în toată
masa lichidului și anume prin apariția
unor bule de vapori în volumul
lichidului Deci eu vaporizare ce
are loc numai la suprafață dar
în volumul lichidului legile fierberii
sunt următoarele prima lege spune
că temperatura de fierbere depinde
doar de presiunea externă și de
natura lichidului deci temperatura
de fierbere o funcție de această
presiune pentru un lichid această
presiune externă e dată de presiunea
vaporilor saturați fierberea conform
celui dat treia legi are loc cu
absorbție de căldură la temperatură
constantă în acesta este un tip
cu totul nou de căldură până acum
căldura era proporțională cu variația
de temperatură dacă vă aduceți
aminte Am definit căldura ca fiind
o constantă înmulțită cu Delta
t și în general căldura este o
măsură a variație de temperatură
a unui sistem termodinamic în cazul
tranzițiilor între stări de agregare
deși avem absorție de căldură pentru
ca aceste tranziții sau transformări
să aibă loc temperatura rămâne
constant în concluzie avem de a
face cu un tip cu totul nou de
căldură Deci căldura Primită în
timpul fierberii se va numi căldura
latentă de polisare Și nu va mai
depinde de temperatură sau variație
temperatură tocmai pentru că aceasta
este constantă Deci nu avem variație
temperatură ceva depinde de masă
lichidului care fierbe care va
fi mulți tăcu o consta această
constantă notată cu Lambda v v
de la vaporizare se numește căldura
latentă specifică de vaporizare
și este o constantă de material
Adică fiecare lichid are o valoare
pentru acest Land of numele de
la tente din de la această proprietate
a căldurii din timpul transformărilor
de fază sau de stare de agregare
de a nu se produce cu variație
de temperatură Deci un fel caldura
ascunsă care nu se manifestă prin
variație temperatură transformările
de stare de agregare sunt reversibile
aceasta înseamnă că procesul invers
fierberii Care este condensarea
unui gaz în lichid se va petrece
cu aceeași căldură schimbată dar
în acest caz avem un semn minus
pentru că la condensare sistemul
cedează căldură pe când la fierbere
sistemul primește căldură dar valoarea
acestui transfer de că fie că este
primită fiecare stii ce dată e
aceea faptul că prin condensare
sistemul cedează căldură o știi
mă din experiența cotidiană Spre
exemplu transpirația este transformarea
lichidului în gaz ceea ce se face
cu absorbție de căldură dinspre
piele spre stratul de transpirație
și în felul acesta pielea se răcește
din această egalitate a căldurilor
scheme bate în cele două stări
transformări de stare de agregare
rezultă că căldurile latente specifice
vor fi egal între cele două procese
de vaporizare și condensare și
în general între transformările
de stări de agregare reversibile
modelul gazului ideal Nu e corect
nici pentru lichid nici pentru
vapori saturați după cum am discutat
din nou în lecțiile de teorie cinetico
molecular hai să discutăm un pic
de ce Acest lucru se întâmplă am
văzut că pentru gazul ideal energia
internă se poate scrie ca am numărul
de moli înmulțită cu capacitatea
specifică molară la volum constant
înmulțită cu temperatura Bineînțeles
că nu putem calcula variației energiei
interne conform acestei ecuații
care din noi este pentru gazul
ideal deoarece al tau ar fi Atunci
proporțional cu Delta t dar test
acord bineînțeles totuși avem o
variației energiei interne când
avem tranziție de la un stare lichidă
la o stare gazoasă Dar ea nu se
extrage conform acestei formule
și mai degrabă folosind principiul
1 al termodinamicii care spune
că va reacții energiei interne
este egal cu diferența dintre căldură
și lucrul mecanic și Deci variației
energiei interne pentru transformare
de stare de agregare va fi egală
cu căldura schimbată adică masă
și căldura latentă specifică a
procesul de spectiv minus lucru
mecanic dacă procesul este izobar
atunci lucrul mecanic este pe Delta
va să discutăm la sfârșitul lecției
despre explicația cinetico moleculară
a transformărilor de fază sau de
stări de agregare în contextul
discuției despre stările de agregare
din cea de a doua lecție de torace
indicând moleculară e foarte ușor
să înțelegem exemplul legile fierberii
dacă vă aduceți aminte dacă nu
vă rog să revizuiți acea lecție
sa discutat despre dependența energiei
potențiale de interacție dintre
molecule de distanța dintre molecule
aer Deci aceasta este energia potențială
de interactiv dintre moleculele
gazului în acel caz și în general
ale sistemului și R este distanța
dintre molecule și am văzut că
dependența este ceva de genul acesta
deci există o distanță R 0 la care
energia potențială are un minim
pe care la notat cu e pe 0 și am
văzut că atunci când distanța dintre
molecule este aproximativ egală
cu aer 0 atunci moleculele vor
fi legate între ghilimele pun legate
legate însemnând aici că ele nu
se pot mișca liber unele față de
altele această stare fiind o stare
tipică pentru un lichid în consecință
dacă distanța dintre molecule de
vine mult mai mare decât acestor
0 atunci moleculele devin liber
adică se pot mișca ușor unele față
de altele aceasta fiind o stare
tipică pentru un o substanță aflată
în stare gazoasă în fine putem
înțelegem proprietățile căldurii
transferate lichidului pentru trecerea
lui în stare gazoasă această căldură
Este o formă de energie care se
transferă lichidului pentru a scoate
moleculele lui din această așa
numită groapă de potențial prezența
moleculelor la o distanță de ordinul
re0 face ca ele Să se afle între
o groapă de potențial care le menține
legate dar dacă furnizăm sistemului
oi energie sub formă de căldură
Care este de ordinul numărului
de molecule sistemului înmulțit
cu adâncimea gropii de potențial
atunci în mod efectiv ce facem
este scoaterea moleculelor din
aceste legături Deci transformarea
sistemului din prostarem lichidă
întruna gazoasă după cum vedem
această căldură Nu generează o
creștere a energiei cinetice medii
Deci acest tip de căldură Nu este
folosit de sistem pentru a crește
energia cinetică medie a moleculelor
această energie cinetică medie
fiind proporțională cu temperatura
Deci acest tip de energie de căldură
nu duce la creșterea temperaturii
în concluzie căldura latentă prezentă
în stările în transformările de
stare nu are loc Salut induce o
variația temperaturii grafică asta
înseamnă că dacă Reprezentăm dependență
temperaturii să zicem în grade
Kelvin de căldură în Juli vom observa
o dependență de felul următor în
stânga avem o stare de agregare
1 în în dreapta avem o stare de
agregare 2 Spre exemplu lichid
și gaz și Pe măsură ce dăm căldură
sistemului temperatura lui va crește
până la o anumită temperatură la
care intrăm pe un palier dăm căldură
în continuare Deci căldura crește
în continuare a sistemului dar
numai observăm o variația temperaturii
de acest palier are loc tranziția
de față sau de stare de agregare
când ia sa terminat de și anumită
temperatură când se termină transformarea
Spre exemplu lichidului în gaz
obținem din nou o creștere a temperaturii
sistemului Cu căldura Care este
furnizat Deci asta înseamnă că
din nou trecem la o generare de
temperatură prin cedarea de căldură
sistemului