Configuraţia electronică a elementelor din primele trei perioade
(elementele cu Z =1 până la Z = 18)
Configuraţia electronică reprezintă distribuţia electronilor în straturile, substraturile şi orbitalii care formează învelişul electronic al unui atom.
Distribuţia electronilor în învelişul electronic depinde de anumite reguli, sau principii. Aceste principii sunt următoarele:
- Principiul stabilităţii sau al minimei energii: electronii preferă să ocupe niveluri de energie cât mai joase, astfel că orbitalii sunt ocupaţi în ordinea creşterii energiei lor – s, p, d, f.
- Principiul lui Pauli sau de excluziune: fiecare orbital al unui atom poate fi ocupat cu maximum doi electroni de spin opus.
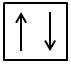 sau
sau 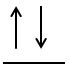
- Regula lui Hund: orbitalii primesc câte un electron cu acelaşi spin (spin paralel), şi numai după ce toţi orbitalii substratului sunt astfel ocupaţi cu câte un electron, se trece la completarea cu cel de-al doilea electron, de spin opus.
Exemplu – completarea substratului 2p cu electroni:
pasul 1: se completează orbitalii cu câte un e- de spin paralel
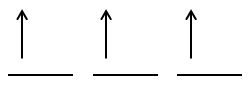
pasul 2: se completează orbitalii cu electronul de spin opus
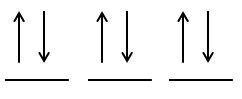
Excepţii de la principiul minimei energii:
- orbitalul 4s are o energie mai joasă decât orbitalii 3d;
- orbitalul 5s are o energie mai joasă decât de orbitalii 4d;
- există şi alte excepţii cu privire la orbitalii de tip f, însă acestea nu fac obiectul lecţiei de faţă.
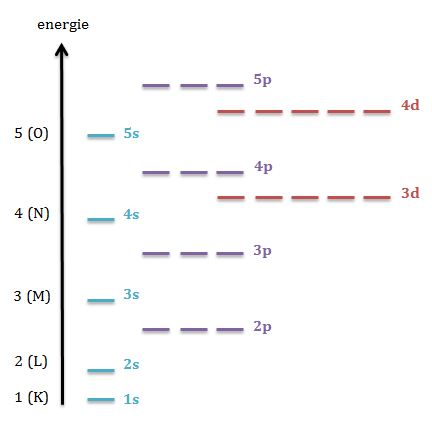
Diagramă de energie – reprezentarea nivelurilor energetice în funcţie de nivelul de energie al fiecărui orbital pentru primele 5 straturi electronice.
Învelişul electronic al fiecărui element, diferă de învelişul electronic al elementului anterior din tabelul periodic numai printr-un electron, numit electron distinctiv. Acest lucru este foarte uşor de observat prin configuraţiile electronice ale elementelor.
Configuraţiile electronice ale elementelor din primele 3 perioade:
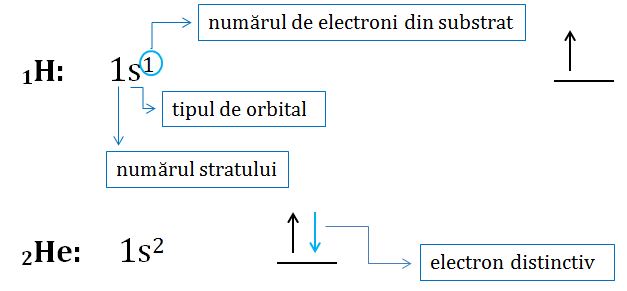
3Li: 1s22s1
5B: 1s22s22p1
6C: 1s22s22p2
Atenţie la modul de completare cu electroni a substratului 2p!
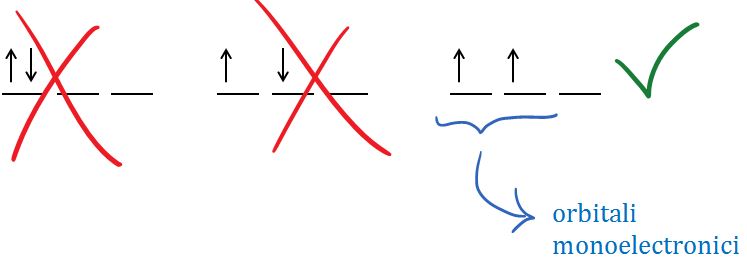
Orbitalii monoelectronici sunt orbitali ce conţin electroni fără pereche, deci conţin câte un singur electron. Prezenţa acestor orbitali explică reactivitatea elementelor chimice.
Structura de 8 electroni pe ultimul strat se numeşte octet. Elementele care au octet pe ultimul strat au o stabilitate foarte ridicată, sau mai putem spune că au o reactivitate foarte redusă.
10Ne: 1s22s22p6
– Neonul este un element foarte stabil şi încheie perioada a doua a tabelului periodic.
11Na: 1s22s22p63s1
– Partea îngroşată a configuraţiei sodiului este identică cu configuraţia neonului, aşadar mai putem scrie configuraţia sodiului în felul următor: 11Na: [Ne]3s1
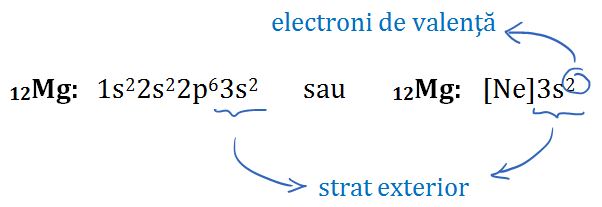
13Al: 1s22s22p63s23p1 sau 13Al: [Ne]3s23p1
18Ar: 1s22s22p63s23p6 sau 18Ar: [Ne]3s23p6

 sau
sau 











