Acidul fluorhidric, HF
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Acidul fluorhidric, HF, este o soluție apoasă de fluorură de hidrogen; este un lichid incolor, otrăvitor, extrem de coroziv, cu miros puternic și înțepător. Prin comparație cu acidul clorhidric, HF este un acid slab, însă atacă puternic sticla și alți silicați. Acidul fluorhidric gazos atacă agresiv căile respiratorii, iar în soluție are un efect caustic asupra pielii.
Preparare
Acidul fluorhidric se prepară prin tratarea fluorinei, CaF2, cu acid sulfuric:
H2SO4 + CaF2 → 2HF + CaSO4
La depozitarea și transportul acidului fluorhidric se folosesc, pentru cantități mici, vase de ebonită, de parafină sau din materiale plastice, iar pentru cantități mai mari, vase de plumb sau butoaie de lemn căptușite cu un strat de parafină.
Acidul fluorhidric se poate obține și prin sinteză direct din elementele componente, însă această reacție este puternic exotermă (are loc cu explozie la temperatura camerei) și nu este folosită ca procedeu tehnic de sinteză:
H2 + F2 → 2HF;  H = -64,2 kcal/mol
H = -64,2 kcal/mol
ProprietățiAcidul fluorhidric este un gaz incolor, care la 19,5°C se lichefiază, trecând într-un lichid incolor ce fumegă puternic. Se solidifică la -83,1°C.
La temperatura și presiunea obișnuită, moleculele de acid fluorhidric sunt asociate; în afară de (HF)2 s-au identificat molecule (HF)6 până la (HF)8. Asocierea se face prin legături de hidrogen:
H — F • • • H — F • • • H — F
Prin ridicarea temperaturii are loc o desfacere a acestor molecule, astfel încât în stare de vapori sunt prezente și molecule simple de acid fluorhidric.
Acidul fluorhidric este solubil în apă; în soluție este slab disociat (numai 15%), spre deosebire de acidul clorhidric, care este un acid tare (disociază complet în apă):
2HF + H2O  [H3O]+ + [HF2]-
[H3O]+ + [HF2]-
HF  H+ + F-
H+ + F-
HF + F- 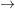 [HF2]-
[HF2]-
Acidul fluorhidric acționează asupra bioxidului de siliciu, formând tetrafluorura de siliciu, SiF4, volatilă. Reacția este caracteristică.
SiO2 + 4HF 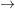 SiF4 + 2H2O
SiF4 + 2H2O
Utilizare
Datorită proprietății acidului fluorhidric de a reacționa cu bioxidul de siliciu și cu silicații, el se întrebuințează la dezagregarea silicaților, la mătuirea, șlefuirea și gravarea sticlei. În metalurgia fină se folosește pentru îndepărtarea nisipului de pe obiectele de metal turnate în forme de pământ.
Acidul fluorhidric este folosit și la prepararea fluorurii de aluminiu sau criolitului sintetic (necesar la fabricarea aluminiului), la prepararea fluorurii de zinc, ZnF2, substanță cu proprietăți antiseptice (întrebuințată uneori la impregnarea lemnului), la fabricarea hârtiei de filtru cantitative (care nu lasă cenușă după calcinare), la prepararea freonilor necesari aparatelor frigorifice, la fabricarea unor antidăunători necesari în agricultură; acidul fluorhidric se mai folosește la decaparea cuprului, alamei, și a oțelului aliat, la curățarea pietrelor și cărămizilor, și pentru dezagregarea minereurilor.
Sărurile acidului fluorhidric
Fluorurile (sărurile acidului fluorhidric) se dizolvă greu în apă, în afară de fluorura de argint, care este ușor solubilă. Cele mai importante fluoruri sunt: fluorura de sodiu, NaF, fluorura de potasiu, KF, fluorura de amoniu, NH4F. În afară de aceste fluoruri neutre, mai sunt cunoscute și fluoruri acide precum: fluorura acidă de sodiu, NaHF2, fluorura acidă de potasiu, KHF2, etc.
Referințe
1. Edith Beral, Mihai Zapan: Chimie Anorganică, ediția a 3-a, Editura Tehnică, București, 1963
2. John Daintith: Dictionary of Chemistry, 6th edition, Oxford University Press, 2008, ISBN 9780199204632






