Numărul combinațiilor carbonului este imens; în combinațiile sale carbonul este în general tetracovalent și numai foarte rar bicovalent.
Elementul cu care carbonul se leagă cel mai frecvent este hidrogenul. Combinațiile carbonului cu hidrogenul se numesc hidrocarburi. Spre deosebire de hidrurile altor elemente, ca de exemplu HCl sau NaH, la care polaritatea legăturii este mare, legăturile dintre C și H în hidrocarburi sunt nepolare (ceea ce se datorează poziției centrale a carbonului în prima perioadă scurtă a tabelului periodic).
Datorită proprietății carbonului de a se combina concomitent cu elemente electropozitive și elemente electronegative, el formează combinații derivate din hidrocarburi prin înlocuirea atomilor de hidrogen cu atomi ai altor elemente, în special cu atomi cu caracter electronegativ. De asemenea, există multe combinații ale carbonului, tot derivate din hidrocarburi specifice (alcooli, aldehide, acizi, etc.)
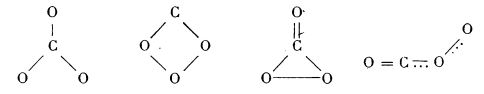
Carbonul formează mai mulți oxizi, din care foarte cunoscuți sunt: dioxidul de carbon, CO2, care este produsul arderii complete a carbonului, și monoxidul de carbon, CO, care este produsul arderii lui incomplete.
Mai există un oxid de carbon mai sărac în oxigen, suboxidul de carbon (sau dioxidul de tricarbon), C3O2 (O = C = C = C = O), care se obține din acid malonic prin eliminare de molecule de apă; de aceea este considerat ca anhidrida acidului malonic:
Suboxidul de carbon este un gaz incolor care se polimerizează cu ușurință trecând într-o substanță amorfă de culoare roșie.
În 1966 a fost izolat și caracterizat un alt oxid al carbonului, și anume trioxidul de carbon, CO3. El a fost obținut în cantități detectabile spectral, într-o matrice de CO2 solid, la temperatura de 77 K și mai jos. Reacția esențială este:
Pe baza unor studii spectrale s-au propus următoarele structuri posibile pentru CO3:
Monoxidul de carbon, CO
Obținere
Monoxidul de carbon (numit și
oxid de carbon în trecut) se formează la arderea cărbunilor în cantitate insuficientă de aer sau oxigen:
2C + O2 = 2CO;  H = -26,4 kcal/mol
H = -26,4 kcal/mol
Monoxidul de carbon se mai formează și prin trecerea dioxidului de carbon peste cărbune înroșit:
CO2 + C  2CO;
2CO;  H = 40,8 kcal/mol
H = 40,8 kcal/mol
Reacția are loc numai la temperaturi înalte (peste 900°C), deoarece altfel echilibrul este deplasat spre stânga. Astfel, dacă printr-un tub (de gresie, porțelan, oțel) ce conține cărbune de lemn în pulbere și este încălzit puternic, se trece un curent de dioxid de carbon, din tub iese oxid de carbon (figura de mai jos), care poate fi identificat prin aprindere (arde cu flacără mică albastră).
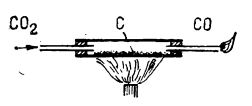 Reducerea dioxidului de carbon cu cărbune
Reducerea dioxidului de carbon cu cărbunePentru a separa dioxidul de carbon rămas neredus, curentul de gaz este trecut, la ieșirea din tubul de reacție, printr-un tub mic, ce conține puțină calce sodată, sau printr-un vas spălător cu hidroxid de sodiu.
În laborator, oxidul de carbon se obține tratând, la 100°C, acid formic, HCOOH, cu acid sulfuric, acesta având acțiune deshidratantă:
HCOOH = CO + H2O
În loc de acid formic se poate folosi și acid oxalic, HOOC-COOH:
HOOC-COOH = CO + CO2 + H2O
Pentru aceasta, în balonul unui dispozitiv de preparare a gazelor la cald (după cum ilustrează figura de mai jos) se tratează acid oxalic cu acid sulfuric concentrat, încălzind până la fierbere.
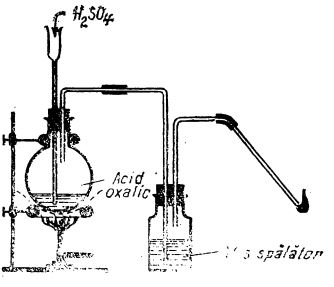 Prepararea oxidului de carbon în laborator
Prepararea oxidului de carbon în laboratorAmestecul de gaze care se degajă este trecut printr-un vas spălător ce conține o soluție diluată de hidroxid de sodiu, unde dioxidul de carbon este reținut; oxidul de carbon trece mai departe și poate fi cules sub apă sau prin deplasarea aerului. (Când oxidul de carbon se prepară din acid formic, vasul spălător nu mai este necesar).
Oxidul de carbon pur rezultă prin descompunerea tetracarbonilului de nichel, Ni(CO)4, la 200°C:
Ni(CO4) ⇌ Ni + 4CO
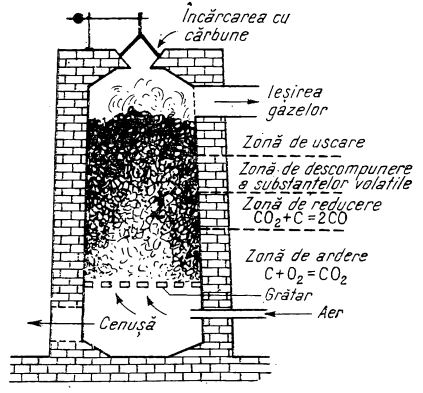
În industrie, oxidul de carbon se prepară în instalații (generatoare de gaz sau gazogene) alcătuite în principiu dintr-un cuptor umplut cu cărbune ilustrat în figura de mai jos:
După aprinderea cărbunelui se introduce prin grătar un curent puternic de aer la 1000-1200°C. Oxigenul din aer oxidează stratul inferior de cărbune înroșit și este redus. Oxidul de carbon format este amestecat cu azotul din aer, cu urme de dioxid de carbon format la început, etc. Acest amestec de gaze se numește gaz de generator. El are următoarea compoziție medie: 25% CO, 4% CO2, 70% N2, iar restul de 1% este format din H2, CH4 și O2. Puterea lui calorifică este de 800-1100 kcal/m3 gaz. Gazul de generator fiind ieftin, este utilizat în industrie drept combustibil.
Dacă în loc de aer se trec vapori de apă peste cărbune înroșit, se obține un amestec de gaze, cunoscut sub numele de gaz de apă, care are în medie următoarea compoziție: 40% CO, 5% CO2, 50% H2 și 5% N2 și CH4. Oxidul de carbon rezultă în acest caz prin reducerea apei de către cărbune, la temperaturi peste 1200°C:
C + H2O = CO + H2;  H = 31,4 kcal/mol
H = 31,4 kcal/mol
La temperaturi sub 1000°C, din reacție rezultă dioxid de carbon:
C + 2H2O  CO2 + 2H2;
CO2 + 2H2;  H = 21,6 kcal/mol
H = 21,6 kcal/mol
Având o putere calorifică de 2500-2800 kcal/m3 gaz, este folosit pentru producerea unei flăcări calde.
Oxidul de carbon din gazul de apă poate fi transformat în dioxid de carbon și hidrogen, dacă se trece împreună cu vapori de apă peste un catalizator:
CO + H2O  CO2 + H2;
CO2 + H2;  H = -9,8 kcal/mol
H = -9,8 kcal/mol
Prin îndepărtarea dioxidului de carbon format rămâne hidrogenul, ce poate fi folosit ca atare.
Gazul mixt este un amestec de gaz de generator cu gaz de apă, obținut prin trecerea concomitentă a unui curent de aer și vapori de apă peste cărbunele înroșit. Compoziția lui medie este: 30% CO, 5% CO2, 15% H2, 50% N2. Are o putere calorifică de 1200-1300 kcal/m3 gaz. Pentru separarea monoxidului de carbon din aceste gaze se trece amestecul de gaze sub presiune printr-o soluție de clorură cuproasă.
Dacă în loc de aer se suflă oxigen, odată cu vaporii de apă, peste cărbune înroșit, se obține un gaz combustibil fără azot, alcătuit în medie din 40% CO, 40% H2, și 20% CO2 care poate fi folosit fie pentru obținerea hidrogenului (după separarea oxizilor de carbon), fie drept gaz de sinteză (după îndepărtarea dioxidului de carbon).
Conversia metanului prin oxidare parțială și tratare catalitică cu vapori de apă, la 850°C este o metodă modernă de obținere a xidului de carbon în industrie:
CH4 + H2O = CO + 3H2
Monoxidul de carbon este un gaz incolor, fără miros și fără gust. Se lichefiază la -190,5°C și se solidifică la -204°C. Are densitatea 0,967. Este greu solubil în apă (la 20°C se dizolvă 2,3 volume monoxid de carbon în 100 volume apă), dar solubil în alcool. El nu întreține arderea, însă arde cu flacără albastră.
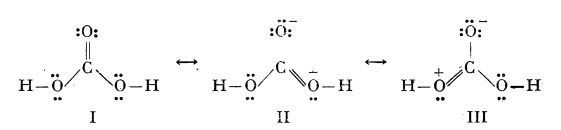
Datorită faptului că proprietățile fizice ale monoxidului de carbon prezintă o mare analogie cu cele ale azotului (vezi
Azotul), moleculele lor conținând același număr de electroni (sunt izoelectronice sau izostere), s-a considerat că atomii componenți din molecula de monoxid de carbon sunt legați printr-o legătură triplă:
Structura reală a moleculei este însă o structură intermediară între structurile:
Din valorile pentru distanța dintre atomi (1,13 Å) și momentul electric al moleculei (0,10 D) rezultă că cea mai mare contribuție la structura reală a moleculei o are structura III (50%).
La temperatura obișnuită monoxidul de carbon este puțin reactiv. Încălzit la 700°C, monoxidul de carbon arde în aer cu formare de dioxid de carbon:
2CO + O2  2CO2;
2CO2;  H = -67,6 kcal/mol
H = -67,6 kcal/mol
Reacția este reversibilă. Oxidarea se produce mai ușor în prezență de catalizator. Din cauza căldurii dezvoltate, oxidul de carbon este un bun combustibil. Un amestec de oxid de carbon și aer, aprins, detonează.
Prin tratarea oxidului de carbon cu vapori de apă rezultă de asemenea dioxid de carbon:
CO + H2O  CO2 + H2
CO2 + H2
La peste 830°C echilibrul este deplasat spre stânga.
Caracteristică este puterea reducătoare a oxidului de carbon. Astfel, la temperatură înaltă reduce mulți oxizi metalici până la metal. De exemplu, reduce oxidul de cupru la cupru metalic:
CuO + CO = Cu + CO2
De aceea, dacă printr-un tub de sticlă greu fuzibilă în care se încălzește puternic o cantitate de oxid de cupru, se trece cu viteză foarte mică, un curent de oxid de carbon (după cum e ilustrat în figura de mai jos), rezultă dioxid de carbon (care poate fi identificat prin barbotare în apă de var). Concomitent se observă depunerea de cupru metalic pe peretele interior al tubului.
Reducerea oxidului de cupru cu oxid de carbon, în laborator
Pe acțiunea reducătoare a monoxidului de carbon se bazează obținerea fontei în furnale.
Monoxidul de carbon se combină la cald cu sulful formând oxisulfura de carbon, COS. Tot așa, prin clorurare directă în prezență de catalizatori se formează oxiclorura de carbon (fosgenul), COCl2, un gaz foarte toxic.
Prin hidrogenare catalitică, monoxidul de carbon se transformă în diferite produse, după condițiile reacției.
Astfel, la 200-300°C și presiune normală, în prezența catalizatorilor de nichel sau cobalt, rezultă metan:
CO + 3H2 = CH4 + H2O
La 170-200°C, tot la presiune normală, dar cu catalizator de cobalt activat cu oxid de magneziu și dioxid de toriu, rezultă hidrocarburi nesaturate:
nCO + 2nH2 = CnH2n + nH2O
La 180-200°C, sub presiune de 300 atm, în prezență de catalizator de ruteniu activat cu carbonat de potasiu, se obțin hidrocarburi saturate superioare:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
La 200-400°C și sub presiune de 200-300 atm, în prezență de oxid de zinc activat cu cupru și oxid de aluminiu, se obține alcool metilic:
CO + 2H2 = CH3OH
La 200°C și 20 atm, în prezență de fier activat cu oxid aluminiu și carbonat de potasiu, se obține un amestec de carbonați sintetici. De exemplu:
17CO + 20H2 = C6H14 + C6H13OH + 5CO2 + 6H2O
Cu unele metale, cum sunt: fierul, cobaltul, nichelul, monoxidul de carbon se combină la cald formând carbonili metalici. De exemplu, cu nichelul formează tetracarbonilul de nichel:
Ni + 4CO = Ni(CO)4
Oxidul de carbon reacționează cu hidroxizii alcalini, la temperaturi înalte sau sub presiune, formând formiați:
CO + NaOH = HCOONa
Oxidul de carbon formează cu clorura de cupru(I) în mediu de acid clorhidric sau de amoniac o combinație de adiție, CuCl · CO · 2H2O, nestabilă. De aceea, pentru a separa oxidul de carbon dintr-un amestec de gaze, acesta este trecut sub presiune printr-o soluție clorhidrică de clorură cuproasă, care reține oxidul de carbon; micșorând apoi presiunea, combinația de adiție se descompune punând oxidul de carbon în libertate.
Oxidul de carbon este foarte toxic; de aceea, toate gazele care conțin oxid de carbon sunt toxice. Toxicitatea lui se datorează afinității mari pentru hemoglobina din sânge: când este inspirat formează cu hemoglobina carboxihemoglobina și împiedică astfel formarea oxihemoglobinei. Este suficientă o concentrație de 0,3% CO în aer pentru a scădea posibilitatea absorbției oxigenului de către sânge, producând în modul acesta sufocare (asfixie). O concentrație de 1% CO în aer provoacă moartea.
În caz de otrăvire cu oxid de carbon, cel otrăvit trebuie scos imediat la aer curat și făcută respirație artificială sau trebuie să i se administreze oxigen, care să deplaseze oxidul de carbon din carboxihemoglobină.
Otrăviri ușoare cu oxid de carbon, manifestate prin dureri de cap, oboseală amețeală până la leșinuri, erau frecvente când se folosea fierul de călcat umplut cu cărbuni sau când se ardeau cărbuni în sobă pentru încălzire, iar arderea nu era completă.
Oxidul de carbon este folosit în industrie, sub formă de gaz de generator, gaz de apă sau gaz mixt, drept combustibil, sau pentru reducerea minereurilor. Importante sunt și întrebuințările lui în sinteze industriale, când se obțin benzine de sinteză, alcooli, aldehide, etc.; de asemenea, mai folosește la fabricarea fosgenului.
Răspândire în natură
Dioxidul de carbon se găsește liber în atmosferă, însă în cantități mici (0,02-0,04%). În spații închise se poate aglomera în cantități mai mari, din cauza proceselor de ardere și respirație, astfel încât poate stânjeni respirația.
Uneori dioxidul de carbon iese din interiorul pământului formând “mofete” (cum sunt cele de la Tușnad sau Covasna). Mai ales din crăpăturile din regiuni vulcanice (ca de exemplu la Neapole - Grota Câinelui) și în regiuni carbonifere ies mari cantități de dioxid de carbon.
Nivelul dioxidului de carbon din atmosferă a crescut considerabil în ultimii 100 de ani, în special din cauza arderilor masive de combustibili fosili și a distrugerii pădurilor tropicale. Cercetătorii consideră că această creștere a dioxidului de carbon atmosferic este cauza principală a încălzirii globale, prin procesul ce se numește efect de seră.
Dioxidul de carbon se găsește în stare combinată sub formă de carbonați: piatră de var și marmură, CaCO3, magnezit, MgCO3, dolomit, MgCO3 · CaCO3, etc. Dizolvat, dioxidul de carbon se găsește în mai toate apele naturale, mai ales în cele gazoase.
În laborator, dioxidul de carbon se prepară prin tratarea marmurei (carbonatului de calciu) cu acidul clorhidric; rezultă clorură de calciu și acid carbonic, H2CO3, care fiind însă foarte nestabil, se descompune imediat în dioxid de carbon și apă:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
În industrie, dioxidul de carbon se obține prin arderea completă a cărbunilor, prin fermentare alcoolică, dar mai ales prin calcinarea unor carbonați care se descompun ușor, ca de exemplu piatra de var:
CaCO3 = CaO + CO2
Uneori, dioxidul de carbon este extras din gazele de ardere de la centralele termice înainte de a fi trimise în atmosferă.
Dioxidul de carbon este un gaz incolor mai greu decât aerul (are densitatea 1,53). Din această cauză el se poate culege în vase ținute cu gura în sus și se poate turna dintr-un vas în altul prin înlocuirea aerului.
Fiind mai greu decât aerul, dioxidul de carbon se adună în pivnițe, mai ales unde au loc fermentații.
Dioxidul de carbon nu arde și nici nu întreține arderea. De aceea, o lumânare aprinsă se stinge când este introdusă într-un vas cu dioxid de carbon. Deoarece dioxidul de carbon nu întreține arderea, nu întreține nici respirația; animalele se sufocă într-o atmosferă de dioxid de carbon. Când se coboară în pivnițe adânci, grote, mine, etc. trebuie luată o lumânare aprinsă sau o brichetă pentru control.
Dioxidul de carbon se lichefiază ușor, chiar numai sub presiune (56,5 atm la 20°C). Lichefiat, se poate transporta în cilindri de oțel (de tipul acelora pentru oxigen). Când se deschide ventilul unui cilindru umplut cu dioxid de carbon lichid, acesta iese cu presiune și se evaporă. Din cauza destinderii de la presiunea de aproape 60 atm la presiunea normală de 1 atm (proces care necesită energie) se produce o răcire puternică; dioxidul de carbon se solidifică într-o masă albă ca zăpada. Această “zăpadă carbonică” formează o rezervă apreciabilă de frigorii cu care se poate scădea temperatura multor substanțe.)
Dioxidul de carbon este solubil în apă (la 20°C se dizolvă 88 volume CO2 în 100 volume H2O). Solubilitatea în apă crește cu presiunea și scade cu ridicarea temperaturii. Soluția apoasă de dioxid de carbon are reacție slab acidă, din cauza disociației acidului carbonic format în urma reacției dintre dioxid de carbon și apă:
CO2 + H2O  H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3-
Molecula dioxidului de carbon are structură liniară simetrică (nu are moment electric). Deoarece distanța C-O este 1,13 Å, deci mai mică decât distanța dintre un atom de carbon și un atom de oxigen legați prin două covalențe, se atribuie moleculei de dioxid de carbon o structură de rezonanță între structurile:
La temperaturi peste 1000°C, dioxidul de carbon se disociază în oxid de carbon și oxigen, gradul de disociere crescând cu creșterea temperaturii.
Fiind o anhidridă acidă, dioxidul de carbon reacționează cu oxizi bazici sau baze, formând carbonați. Astfel, trecut printr-o soluție limpede de apă de var, o tulbură, din cauza formării carbonatului de calciu, insolubil:
Ca(OH)2 + CO2 = CaCO3 + H2O
Reacția folosește la identificarea dioxidului de carbon.
Dioxidul de carbon este o combinație stabilă. Numai la temperatură înaltă reacționează cu metale puternic electropozitive, cum sunt potasiul, magneziul, zincul, cărora le cedează oxigen. De aceea, dacă într-o atmosferă de dioxid de carbon se introduce o panglică de magneziu aprinsă, ea continuă să ardă; se formează oxid de magneziu și carbonul este pus în libertate:
CO2 + 2Mg = 2MgO + C
Dacă trece dioxid de carbon peste cărbune înroșit, el este redus la oxid de carbon, reacția fiind reversibilă.
Concentrații mici de dioxid de carbon nu sunt dăunătoare organismului; astfel, dioxidul de carbon existent în sânge are acțiune excitantă asupra centrilor respiratorii. În cantități mari însă, dioxidul de carbon produce sufocare.
Unele utilizări ale dioxidului de carbon se pot confunda cu întrebuințările carbonatului de calciu, deoarece în industrie dioxidul de carbon se obține direct prin descompunerea carbonatului de calciu (de exemplu la prepararea carbonatului de sodiu după procedeul cu amoniac).
Dioxidul de carbon este folosit la fabricarea ureei, la fabricarea acidului salicilic (un acid organic întrebuințat la fabricarea unor medicamente, de exemplu a aspirinei), la fabricarea băuturilor gazoase (sifon, limonade, vinuri spumoase, bere, etc).
Deoarece nu întreține arderea, dioxidul de carbon se utilizează la stingerea incendiilor produse mai ales de petrol, păcură, benzină, care nu se pot stinge cu apă (aceste produse fiind ușoare, plutesc pe apă, cu care nu se amestecă, și continuă astfel să ardă; aducând însă peste ele dioxid de carbon, ele sunt izolate de aer și astfel arderea încetează din lipsă de oxigen).
Pentru stingerea incendiilor, dioxidul de carbon se prepară în momentul utilizării, prin acțiunea acidului sulfuric sau clorhidric asupra carbonatului de sodiu, în aparate numite stingătoare (extinctoare).
Scăderea de temperatură produsă prin evaporarea dioxidului de carbon lichid se folosește și la prepararea zăpezii carbonice (gheață uscată), formă sub care este întrebuințat la instalații frigorifice la conservarea alimentelor.
Cei mai simpli oxoacizi ai carbonului și sărurile lor sunt:
H2CO3 - acidul carbonic MI2CO3 - carbonați
H2C2O4 - acidul oxalic MI2C2O4 - oxalați
HCOOH - acidul formic HCOOMI - formiați
CH3COOH - acidul acetic CH3COOMI - acetați
După formulele sărurilor neutre ale acestor acizi se observă că acidul formic și acidul acetic sunt monobazici, pe când acidul carbonic și acidul oxalic sunt dibazici.
Dintre aceștia, acidul oxalic, acidul formic și acidul acetic sunt studiați în cadrul chimiei organice.
Acidul carbonic, H2CO3
Acidul carbonic se formează prin dizolvarea dioxidului de carbon în apă. Fiind însă foarte nestabil, se descompune în dioxid de carbon și apă (echilibrul reacției este deplasat mult spre stânga), astfel încât în soluție se găsește dizolvată numai o cantitate de acid, care este parțial disociat în ioni:
CO2 + H2O ⇌ H2CO2 ⇌ 2H+ + CO32-
Acidul carbonic este un acid dibazic slab:
H2CO3 ⇌ H+ + HCO3-; K1 = 4,45 · 10-7
HCO3- ⇌ H+ + CO32-; K2 = 5,7 · 10-11
Sărurile acidului carbonic -
carbonații - sunt substanțe stabile.
Ca orice acid dibazic, acidul carbonic formează două tipuri de carbonați: carbonați neutri, M2ICO3, și carbonați acizi, MIHCO3, (aceștia din urmă - carbonații de hidrogen și metal - mai sunt cunoscuți sub denumirea veche de bicarbonați).
Carbonații alcalini se pot obține prin introducerea unui curent electric de CO2 în soluția hidroxidului alcalin respectiv. De exemplu:
KOH+CO2 = KHCO3
KHCO3 + KOH = K2CO3 + H2O
Ceilalți carbonați se obțin prin reacții de dublu schimb între carbonații alcalini și o sare solubilă a metalului respectiv.
Carbonații sunt substanțe solide, cristalizate. Cei neutri sunt greu solubili în apă, cu excepția carbonaților alcalini; cei acizi sunt toți solubili în apă, în afară de carbonatul acid de sodiu, NaHCO3, care este mai greu solubil. Soluțiile carbonaților au reacție bazică, din cauza hidrolizei:
MI2CO3 + H2O ⇌ MIHCO3
MIHCO3 + H2O ⇌ MIOH + H2CO3
Prin fierberea soluțiilor, carbonații acizi pierd CO2 și trec în carbonați neutri:
2KHCO3 = CO2 + H2O + K2CO3
De exemplu, dacă în apă de var se barbotează un curent de dioxid de carbon, până la saturare, la început se formează un precipitat alb de carbonat de calciu:
CO2 + Ca(OH)2 = CaCO3 + H2O
care, la continuarea barbotării gazului dispare, deoarece excesul de dioxid de carbon transformă carbonatul neutru de calciu, insolubil, în carbonat acid de calciu, care este solubil:
CO2 + H2O + CaCO3 = Ca(HCO3)2
Prin încălzire, carbonații neutri se descompun în oxidul metalului respectiv și dioxid de carbon:
MgCO3 = MgO + CO2
Excepție fac carbonații alcalini, care la încălzire se topesc fără să se descompună.
Carbonații acizi ai metalelor alcaline, prin încălzire, trec în carbonații neutri respectivi:
2NaHCO3 = Na2CO3 + CO2 + H2O
De aceea, la fierbere, din cauza formării carbonatului neutru de calciu, o soluție limpede de carbonat de calciu se tulbură:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Carbonații, chiar dacă sunt insolubili, reacționează cu acizii și se dezvoltă dioxid de carbon. Reacția între carbonatul de calciu și acidul clorhidric este reacția de recunoaștere a carbonaților:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Dintre carbonați, mai importanți sunt carbonații de calciu, sodiu, potasiu.
Acidul carbonic are o structură intermediară între structurile:
Această rezonanță, uneori inhibată în cazul acidului, este completă în cazul ionului carbonat. Acesta are o structură plană, cu unghiurile între legăturile C-O de 120° și toate cele trei distanțe C-O egale cu 1,30 Å.
Sulfura de carbon se obține prin trecerea vaporilor de sulf peste cărbune înroșit:
C + 2S ⇌ CS2;  H = +22 kcal/mol
H = +22 kcal/mol
În industrie se prepară în cuptoare electrice, vaporii de sulfură de carbon fiind condensați prin răcire.
Molecula sulfurii de carbon este liniară, distanța C-S fiind de 1,55 Å. Are o structură de rezonanță de același tip ca și dioxidul de carbon.
În stare pură, sulfura de carbon este un lichid incolor cu miros aromat; de obicei are însă miros neplăcut de varză stricată, datorită impurităților pe care le conține. Are densitatea 1,26. Sulfura de carbon este foarte volatilă (punctul de fierbere este 46,2°C), iar vaporii ei sunt ușor inflamabili. Arde cu flacără albastră, formând un amestec de dioxid de sulf și dioxid de carbon:
CS2 + 3O2 = CO2 + 2SO2;  H = -258 kcal/mol
H = -258 kcal/mol
Temperatura de aprindere a sulfurii de carbon în aer este de 23,6°C. Cenușa fierbinte a unei țigări aprinse, sau un bec electric obișnuit pot aprinde vaporii de sulfură de carbon. Un amestec de vapori de sulfură de carbon și aer poate exploda ușor.
Sulfura de carbon se descompune la lumină, de unde provine culoarea gălbuie pe care o are în mod obișnuit. Apa o hidrolizează la temperatură peste 400°C:
CS2 + 2H2O = CO2 + 2H2S
Oxidanții puternici o descompun cu separare de sulf.
Sulfura de carbon este puțin solubilă în apă; este însă miscibilă cu alcool, eter și cloroform. Fiind un bun dizolvant pentru iod, fosfor, sulf, uleiuri, grăsimi, rășini, cauciuc etc., sulfura de carbon este întrebuințată în tehnică pentru a extrage grăsimile din substanțele pe care le conțin: uleiuri din plante, esențe din flori, grăsimi din lână (lanolina) etc., cât și pentru dizolvarea cauciucului, rășinilor etc.
Cantități mari de sulfură de carbon se folosesc la fabricarea vîscozei și ca insecticid în agricultură. Ea mai servește ca materie primă în chimia organică, pentru prepararea unor combinații, cum este de exemplu tetraclorura, CCl4, un dizolvant tot așa de bun ca și sulfura de carbon, dar care nu este inflamabil.
Mânuirea sulfurii de carbon trebuie făcută cu atenție, deoarece este inflamabilă și toxică.
Prin combinații cianice se înțeleg acele substanțe care conțin în moleculă radicalul monovalent -CN. După cum radicalul amoniu, -NH4, prin proprietățile sale, se apropie de halogeni.
Radicalul -CN nu există în stare liberă; dacă ionul CN- pierde sarcina electrică, atunci se combină cu alt ion (care a pierdut și el sarcina electrică), formând dicianul, (CN)2, un gaz incolor, toxic, numit de obicei cian.
Cea mai importantă combinație cianică este acidul cianhidric, HCN, și sărurile sale, cianurile.
Acidul cianhidric, HCN, numit și
acid prusic, se găsește în plante, fie în stare liberă, fie combinat. De exemplu, amigdalina, substanță care se găsește în sâmburii de migdale, prune etc., este un compus al acidului cianhidric. Gazele de cocserie conțin cantități mici de acid cianhidric.
Acidul cianhidric se prepară prin acțiunea acidului sulfuric asupra cianurii de potasiu:
2KCN + H2SO4 = 2HCN + K2SO4
În industrie se obține trecând un amestec de amoniac (sau chiar azot) și metan, 1000°C, peste un catalizator de platină:
CH4 + NH3 + 3/2 O2 = HCN + 3H2O;  H=-115 kcal/cal
H=-115 kcal/cal
Acidul cianhidric este un lichid incolor, care fierbe la 26,5°C și are un miros intens de migdale amare. Este miscibil cu apa în orice proporții, la fel cu eterul și alcoolul.
Molecula acidului cianhidric este liniară, distanța C-N fiind de 1,15 Å.
Este un acid slab; de aceea, sărurile sale hidrolizează.
Acidul cianhidric este foarte toxic; 50 mg omoară un om în câteva secunde.
Acidul cianhidric este întrebuințat la prepararea cianurilor alcaline sau a altor combinații cianice, precum și în sinteze din chimia organică. Importantă este folosirea lui la sinteza acrilonitrilului, monomer pentru rășina sintetică poliacrilonitril. Se mai utilizează ca antidăunător. Cianurile alcaline se folosesc la extragerea aurului și a argintului prin metoda cianurării. Unele cianuri sunt folosite în galvanotehnică. Întrebuințările acidului cianhidric cât și a sărurilor sale se fac cu deosebită atenție din cauza toxicității lor extreme.
Sărurile acidului cianhidric, cianurile, au compoziție corespunzătoare formulei MICN. Cianurile sunt clasificate în cianuri ionice, cianuri covalente, cianuri complexe și derivații metalici ai acestor complecși.
Cianurile ionice sunt formate din metale cu caracter electropozitiv pronunțat, cum sunt metalele alcaline (cu excepția litiului) și metalele alcalino-pământoase. În ionul de cianură, CN
-, distanța C-N este de 1,05 Å legătura având 57% caracter ionic. Structura acestui ion presupune rezonanța între formele:
Cianurile metalelor alcaline sunt ușor solubile în apă; din cauza hidrolizei, soluțiile apoase au o reacție puternică bazică și miros de acid cianhidric.
Cianurile covalente sunt formate de metalele cu caracter electropozitiv mai puțin pronunțat, ca de exemplu argintul, precum și de metalele bivalente cupru, nichel, platină, paladiu. Cianura de argint, AgCN, rezultă sub formă de precipitat alb brânzos la tratarea unei sări de argint cu o cianură:
Ag+ + CN- = AgCN
Studii cu raze X au arătat că acest compus are o structură de lanț format din grupe alternative de Ag și CN:
Cianurile complexe sunt formate, în special, de metalele de tranziție. Ele se caracterizează prin deosebită stabilitate și au proprietăți diferite de cele ale cationilor de la care derivă. În asemenea complecși, metalele prezente sunt bi-, tetra-, hexa- și octo-coordinate. Astfel, Ni în în complexul [Ni(CN)
4]
2- este teracoordinat; Fe în [Fe(CN)
6]
3- este hexacoordinat.
Cianuri complexe mai cunoscute sunt: hexacianoferatul(II) de potasiu, K4[Fe(CN)6], numit înainte ferocianură de potasiu, care rezultă din cianură de fier(II):
4KCN + Fe(CN)2 = K2[Fe(CN)6]
precum și hexacianoferatul(III) de potasiu, K3[Fe(CN)6], cunoscut ca fericianura de potasiu, care derivă din cianura de fier(III):
3KCN + Fe(CN)3 = K3[Fe(CN)6]
Sărurile de metale alcaline și alcalino-pământoase ale cianurilor complexe sunt solubile în apă; cele ale ionilor metalelor de tranziție și de Cu(II) formează însă precipitate gelatinoase, insolubile.
Prin carburi se înțeleg combinațiile carbonului cu un alt element. Deoarece compușii carbonului cu elemente mai electronegative, ca de exemplu halogenii, oxigenul, sulful sunt considerați însă de preferință halogenuri, respectiv oxizi, sulfuri, se consideră drept carburi adevărate compușii carbonului cu elemente mai electropozitive.
Pe baza tipului de legătură prezent în moleculă, carburile se clasifică în ionice, covalente și interstițiale.
Carburile ionice sau
saline sunt formate de metalele din grupele I, II și III. Acești compuși se prezintă sub formă de cristale transparente; în stare solidă nu conduc curent electric. Tratate cu apă sau cu acizi formează hidrocarburi datorită hidrolizei ionilor negativi.
1. Carburi care la hidroliză dau metan, CH4, (metanuri) sunt carbura de beriliu, Be2C, și carbura de aluminiu, Al4C3:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3
2. Carburi care la hidroliză dau acetilenă, C2H2 (acetiluri) sunt carburile unor metale din grupele I, II și III. Ele sunt de tipul M2C2 și MC2. De exemplu, Na2C2, CaC2, Cu2C2, Ag2C2.
Dintre acestea cea mai importantă este carbura de calciu.
Carbura de calciu, CaC
2, numită și
carbid, se fabrică din var și cărbune, la circa 2000°C:
CaO + 3C ⇌ CaC2 + CO;  H = 108 kcal/mol
H = 108 kcal/mol
Temperaturi mai joase favorizează reacția în sens contrar; temperaturi peste 2500°C sunt nefavorabile, deoarece carbura se descompune:
CaC2 → Ca + 2C
Fabricația se realizează în cuptoare prevăzute cu electrozi de grafit (figura de mai jos) prin care trece un curent electric de intensitate până la 100 000 A.
Cuptor electric pentru fabricarea carbidului
Gazele ieșite din cuptor, care conțin oxidul de carbon, sunt captate și folosite drept combustibil pentru uscarea materiilor prime.
Carbura de calciu pură se prezintă sub formă de cristale aciculare albe.
Deoarece carbidul tehnic conține impurități, acetilena care se degajă prin acțiunea apei asupra carbidului nu este niciodată pură:
CaC2 + 2H2O = C2H2 + Ca(OH)2
Acetilena produsă astfel conține printre impurități și hidrogen fosforat, care îi imprimă mirosul neplăcut și poate provoca explozii în instalațiile cu acetilenă.
Carbidul este un produs industrial foarte important. În afară de întrebuințarea lui curentă pentru prepararea acetilenei, mai folosește la fabricarea cianamidei de calciu (și de potasiu) și uneori, ca reducător în metalurgie.
Cianamida de calciu, CaCN
2, se obține prin acțiunea azotului asupra carburii de calciu, la 1100°C:
CaC2 + N2 = CaCN2 + C  H = -72 kcal/mol
H = -72 kcal/mol
În stare pură este o masă albă; de obicei are însă o culoare neagră-cenușie.
La temperatură înaltă este descompusă de vaporii de apă:
CaCN2 + 3H2O = CaCO3 + 2NH3
Aceeași descompunere cu produse finale amoniac și carbonat de calciu, se produce în pământ, la temperatura obișnuită, sub acțiunea unor bacterii din sol; de aceea, cianamida de calciu este folosită drept îngrășământ.
3. Carburi care la hidroliză dau un amestec de hidrocarburi nesaturate sunt carburile de toriu, de uraniu și de unele lantanide.
Carbura de siliciu, SiC, numită și
carborund, se prepară industrial prin încălzirea în cuptor electric, la circa 2000°C, a unui amestec de cărbune (cocs) și dioxid de siliciu:
3C + SiO2 = SiC + 2CO
Carbura de siliciu are densitatea 3,2. Este bună conducătoare de căldură, asemănându-se prin aceasta cu grafitul; prin duritatea ei mare se aseamănă însă mai mult cu diamantul.
Carbura de siliciu pură este incoloră; de obicei este însă neagră, din cauza carbonului cu care este amestecată. Este foarte stabilă față de agenții chimici, chiar față de acizii oxidanți. Este atacată numai prin topire cu hidroxizi alcalini în prezența unui oxidant, deosebindu-se prin aceasta de diamant, de care se poate separa în acest mod.
În rețeaua cristalină a carburii de siliciu, atomii de carbon și de siliciu sunt așezați alternativ, fiecare fiind înconjurat tetraedric de ceilalți atomi. La ruptura structurii trebuie să se rupă deci un mare număr de legături. Așa se explică temperatura de descompunere înaltă (2200°C), inerția chimică, precum și duritatea foarte mare (9,15) a acestei carburi.
Din cauza durității ei mari se întrebuințează la prepararea prafului și pastei de șlefuit, a diferitelor obiecte dure, la tăiatul sticlei și a porțelanului (în locul diamantului); în electrotehnică, ca rezistențe pentru cuptoare electrice (silită) etc. Din carbură de siliciu se pot fabrica creuzete de laborator rezistente la temperatură înaltă și agenți chimici.
Carburi interstițiale sunt formate de metale de tranziție din grupele IV, V și VI. Ele sunt de tipul MC (unde M = Ti, Zr, Hf, V, Nb, Ta, Mo, W) și de tipul M
2C (unde M = V, Mo, W), atomii de carbon ocupând poziții interstițiale în rețelele cristaline ale metalelor, fără a le produce o deformare substanțială. Acești compuși se caracterizează prin opacitate, luciu metalic și conductibilitate electrică mare; au duritate mare, puncte de topire înalte și inerție chimică. Cele de tip MC au rețea cubică compactă, pe când cele de tip M
2C au rețea hexagonal compactă.
Metalele de tranziție Mn, Fe, Co, Ni sau carburi de tipul M3C (cromul formează Cr3C2), care, deși formal sunt similare carburilor interstițiale, se deosebesc de acestea prin faptul că reacționează cu apa sau cu acizi diluați dând hidrocarburi. Din această categorie face parte carbura de fier, Fe3C, cementita, care are deosebită însemnătate în metalurgia fierului.
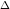 H = -26,4 kcal/mol
H = -26,4 kcal/mol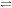 2CO;
2CO; 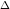 H = 40,8 kcal/mol
H = 40,8 kcal/mol

 H = 31,4 kcal/mol
H = 31,4 kcal/mol CO2 + 2H2;
CO2 + 2H2;  H = 21,6 kcal/mol
H = 21,6 kcal/mol CO2 + H2;
CO2 + H2;  H = -9,8 kcal/mol
H = -9,8 kcal/mol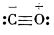
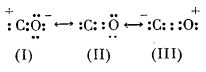
 2CO2;
2CO2;  H = -67,6 kcal/mol
H = -67,6 kcal/mol CO2 + H2
CO2 + H2 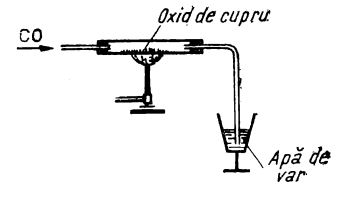
 H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3-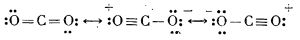
 H = +22 kcal/mol
H = +22 kcal/mol H = -258 kcal/mol
H = -258 kcal/mol H=-115 kcal/cal
H=-115 kcal/cal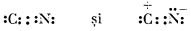
 H = 108 kcal/mol
H = 108 kcal/mol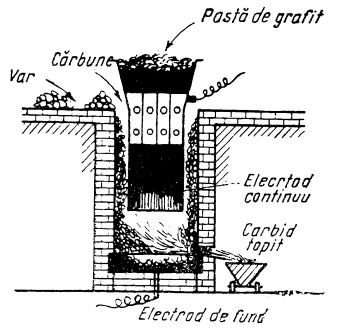
 H = -72 kcal/mol
H = -72 kcal/mol





