Grupa I principală a sistemului periodic, numerotată I A sau 1, cuprinde elementele litiu, Li, sodiu, Na, potasiu, K, rubidiu, Rb, și cesiu, Cs, precum și elementul radioactiv franciu, Fr. Ea se mai numește și grupa metalelor alcaline, deoarece hidroxizii reprezentanților principali ai grupei sunt cunoscuți sub numele de alcalii.
Atomii elementelor din această grupă conțin un singur electron pe învelișul electronic exterior:
Datorită singurului electron de valență din învelișul electronic exterior numărul de oxidare caracteristic grupei este unu. Stratul electronic anterior este format din opt electroni s2p6 (cu excepția litiului, la care este format din doi electroni, s2), strat de gaz rar.
Ca urmare a așezării lor în sistemul periodic, imediat după gazele rare, elementele din această grupă au tendința accentuată ca prin cedarea unicului lor electron exterior să dobândească configurația electronică a acestora:
X0 - e- 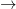 X+
X+
Energia de ionizare pentru acest electron este foarte mică, spre deosebire de energia ce ar trebui aplicată pentru a ioniza un al doilea electron. De exemplu, în cazul litiului, energia de ionizare pentru:
M 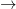 M+ + e-
M+ + e-
este 123,8 kcal/atom-gram, pe când energia de ionizare pentru:
M+ 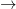 M2+ + e-
M2+ + e-
ar trebui să fie 1736,86 kcal/atom-gram.
Aceasta se datorează faptului că la metalele alcaline sarcina nucleară din atom este oarecum ecranată de stratul electronic de gaz rar, astfel încât electronul exterior este numai slab legat. Legătura este cu atât mai slabă cu cât numărul cuantic principal este mai mare. Așa se explică caracterul puternic electropozitiv al metalelor alcaline și accentuarea acestui caracter de la litiu la cesiu. Totodată se înțelege de ce la metalele alcaline razele atomice sunt foarte mari, spre deosebire de razele ionice (de exemplu, la litiu, raza atomică are 1,55 Å, pe când raza ionică are 0,70 Å).
Metalele alcaline manifestă cea mai mare tendință de ionizare dintre toate elementele din sistemul periodic. Numai halogenii manifestă o afinitate pentru electron așa de accentuată, însă pentru a forma anioni.
Din cauza existenței unui electron necuplat în stratul electronic exterior, elementele grupei I principale ar trebui în principiu să formeze și covalențe. Se cunosc unele combinații organice ale metalelor alcaline (de exemplu alchilii de metale alcaline), unde acestea sunt legate covalent. În general, însă, tendința de a ceda electronul exterior este predominantă față de tendința de a-și mări numărul de electroni exteriori.
Caracteristicile elementelor din grupa I principală a sistemului periodic
| Caracteristici |
Litiu
Li |
Sodiu
Na |
Potasiu
K |
Rubidiu
Rb |
Cesiu
Cs |
Franciu
Fr |
| Numărul atomic |
3 |
11 |
19 |
37 |
55 |
87 |
| Configurația electronică exterioară |
2s1 |
3s1 |
4s1 |
5s1 |
6s1 |
7s1 |
| Masa atomică |
6,939 |
22,989 |
39,102 |
85,47 |
132,90 |
[223] |
| Densitatea (s), g/cm3 |
0,53 |
0,97 |
0,86 |
1,53 |
1,90 |
- |
| Punctul de topire, °C |
108,5 |
97,8 |
63,7 |
38,9 |
28,7 |
- |
| Punctul de fierbere, °C |
1330 |
892 |
760 |
688 |
690 |
[27] |
| Potențial de ionizare, eV |
5,39 |
5,14 |
5,34 |
4,18 |
3,89 |
- |
| Electronegativitatea (Pauling) |
1,0 |
0,9 |
0,8 |
0,8 |
0,7 |
0,7 |
| Raza de covalență, Å |
1,34 |
1,54 |
1,96 |
2,06 |
2,18 |
- |
| Raza ionică (pentru X+), Å |
0,70 |
1,00 |
1,33 |
1,52 |
1,70 |
1,90 |
Observație. Energiile de ionizare pot fi exprimate și în kcal/mol, valorile respective obținându-se prin înmulțirea valorilor potențialului de ionizare exprimat în eV, cu factorul de conversie: 23,053.
Se observă că la metalele alcaline, variația proprietăților este în strictă concordanță cu prevederile pe baza configurației electronice și ale sarcinilor nucleare ale atomilor componenți. Astfel, pe măsura așezării electronilor pe nivele de energie din ce în ce mai înalte se observă creșterea dimensiunii atomice cu creșterea numărului atomic. Aceasta se reflectă în valorile volumelor și razelor atomice și deci și în razele ionilor în cristale.
Toate aceste metale sunt moi, astfel încât se pot tăia cu cuțitul; suprafața lor în tăietură proaspătă are luciu argintiu (în afară de cesiu, care este galben ca aurul). Se remarcă densitatea mică și punctele de topire și de fierbere foarte scăzute.
Metalele alcaline în stare de vapori sunt monoatomice. Însă, în anii ‘60, s-a descoperit că, mai ales la metalele alcaline ușoare, se produce și o asociație de atomi cu formare de molecule biatomice. De exemplu, la vaporii de sodiu, proporția de molecule asociate este de circa 17%, iar la litiu chiar de 28%.
Vaporii metalelor alcaline sunt colorați; cei de sodiu în purpuriu, cei de potasiu în albastru-verzui, cei de rubidiu în verde-albăstrui, etc. Colorații similare au și soluțiile coloidale obținute prin dispersia electrică a metalelor într-un dizolvant organic, ca de exemplu eter etilic.
Un metal alcalin sau o sare a lui mai volatilă, introdusă într-o flacără, o colorează caracteristic, și anume: litiul în roșu carmin, sodiul în galben, potasiul în violet, rubidiul în roșu închis și cesiul în albastru. Dacă flacăra se cercetează cu un spectroscop, se observă linii a căror poziție este caracteristică fiecărui metal alcalin.
Studii cu spectrograful de masă au arătat că sodiul și cesiul sunt elemente unitare, pe când celelalte sunt formate din mai mulți izotopi. Dintre cei trei izotopi ai potasiului cu masele atomice 39, 40 și 41, care se gpsesc în proporțiile 93,260:0,0119:6,729. Izotopul 40K este radioactiv (cu perioadă de înjumătățire 1,18·109 ani); prin dezintegrarea radioactivă a potasiului rezultă argon, 40Ar).
Rubidiul are de asemenea un izotop radioactiv, și anume
87Rb, care se găsește amestecat cu
85Rb, în proporție de 27,85%. Timpul lui de înjumătățire este este de 4,6·10
10 ani. Prin emisie de particule
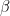
, izotopul
87Rb trece în izotopul stabil de stronțiu,
87Sr.
De la franciu se cunosc opt izotopi, toți instabili.
Metalele alcaline sunt foarte reactive din punct de vedere chimic, de aceea ele nu se găsesc libere în natură.
Litiul, primul element din grupă, în comportarea lui se aseamănă mai mult cu metalele alcalino pământoase decât cu omologii lui din grupă. Și sodiul, al doilea element din grupă, prezintă o comportare mai deosebită față de celelalte elemente din grupă, însă nu atât de evidentă ca în cazul litiului. La al treilea element al grupei, potasiul, începe să se manifeste accentuat caracterul grupei. Grupa I principală este un exemplu pentru regula valabilă pentru tot sistemul periodic, și anume că abia la al doilea sau al treilea element din grupa principală se manifestă pregnant caracterul grupei; primul element din grupă, prin comportarea lui, se apropie deseori de elementele grupei principale care urmează în sistem, iar al doilea element din grupă are uneori proprietăți comune cu grupa secundară respectivă.
Elementele grupei I principale având potențiale de ionizare foarte mici, sunt așezate la începutul seriei tensiunilor electrochimice. Ele reacționează cu deosebită ușurință cu ionii de hidrogen, în sensul că aceștia pot scoate electronul din atomul metalului alcalin:
M + H+ = M+ + ½ H2
Dacă se trece hidrogen peste un metal alcalin ușor încălzit, rezultă o hidrură (în care hidrogenul este componentul electronegativ):
Na + ½ H2 = Na+H-
Metalele alcaline descompun energic apa sau alcoolul, cu eliberare de hidrogen:
Na + H2O = NaOH + ½ H2
Na + C2H5OH (alcool etilic) = C2H5ONa (etoxid de sodiu) + ½ H2
Reactivitatea crește odată cu creșterea masei atomice a elementului. Astfel, pe când sodiul reacționează cu apa atât de energic, încât căldura de reacție dezvoltată topește metalul, fără însă să se producă aprinderea hidrogenului, la potasiu reacția este atât de violentă incât hidrogenul dezvoltat se aprinde.
Ținute în aer umed, metalele alcaline se acoperă cu o crustă de hidroxid, din care cauză se păstrează sub petrol.
Prin ușoară încălzire în aer sau oxigen, metalele alcaline se aprind și ard formând peroxizi, M2IO2 (de exemplu peroxidul de sodiu, Na2O2) și superoxizi (numiți în trecut hiperoxizi), MIO2 (de exemplu superoxidul de potasiu, KO2, sau superoxidul de rubidiu, RbO2), în afară de litiu, care formează un oxid normal, oxidul de litiu, Li2O. Oxizii normali ai metalelor alcaline, cu excepția oxidului de litiu, se obțin numai indirect; sunt substanțe solide, culoarea lor variind de la alb (Li2O) la portocaliu (Cs2O).
Peroxizii, prin tratare cu apă sau cu acizi se descompun cu formare de apă oxigenată:
M2IO2 + 2H2O = 2MIOH + H2O2
M2IO2 + H2SO4 = M2ISO4 + H2O2
pe când superoxizii se descompun cu formare de apă oxigenată și oxigen:
2MIO2 + 2H2O = 2MOIH + H2O2 + O2
2MIO2 + H2SO4 = M2ISO4 + H2O2 + O2
Hidroxizii metalelor alcaline sunt substanțe incolore, foarte solubile în apă, dizolvarea fiind însoțită de o puternică degajare de căldură. Ele sunt baze tari; caracterul bazic crește de la hidroxidul de litiu la hidroxidul de cesiu (care este cea mai tare bază). În stare topită, hidroxizii alcalini atacă sticla și porțelanul, chiar platina.
Metalele alcaline reacționează cu halogenii formând săruri tipice. Și aici se observă intensificarea energiei de combinare odată cu creșterea masei atomice a metalului alcalin. De exemplu, sodiul reacționează liniștit cu bromul, pe cînd potasiul, în contact cu bromul, produce explozie.
Sărurile metalelor alcaline sunt incolore și aproape toate ușor solubile în apă (doar sărurile cu litiu sunt mai greu solubile). Ele cristalizează din soluție, de multe ori sub formă de hidrați cristalini. Sărurile metalelor alcaline cu acizi slabi în soluție au reacție puternic bazică (din cauza hidrolizei).
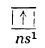
 X+
X+ M+ + e-
M+ + e- M2+ + e-
M2+ + e-





