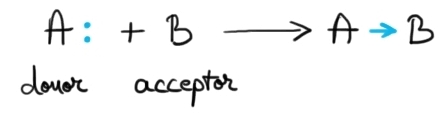Legătura coordinativă este o legătură covalentă polară în care dubletul de legătură provine de la un singur atom. Legătura coordinativă se formează între o specie chimică care are o pereche de e- neparticipanți numită donor, și o specie chimică care are deficit de e- numită acceptor. Acest tip special de legătură covalentă se reprezintă printr-o săgeată orientată de la donor la acceptor.
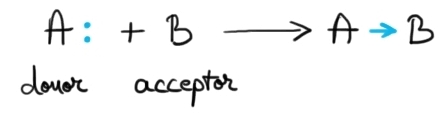
Un exemplu clasic este formarea clorurii de amoniu:
Combinațiile complexe, numite și compuși de coordinație sau compuși coordinativi, sunt compuși chimici care conțin un ion sau atom de metal (numit ion central sau centru de coordinare) legat prin legături coordinative de unul sau mai mulți liganzi, care sunt ioni sau molecule ce conțin una sau mai multe perechi de electroni ce pot fi împărțite cu metalul.
Numărul de coordinare al unei combinații complexe este dat de numărul de liganzi care sunt legați coordinativ de ionul central.
Combinațiile complexe pot fi neutre din punct de vedere electric, sau pot avea sarcină negativă precum ionul [Zn(OH)4]2-, ori sarcină pozitivă precum ionul [Cu(NH3)4]2+. Combinațiile complexe care au sarcină electrică se mai numesc și ioni complecși.
Calculul sarcinii ionului complex:
- când liganzii sunt molecule: sarcina ionului complex este pozitivă și egală cu sarcina ionului central.
Exemplu: Ionul de tetraaminocupru are sarcina +2, dată de ionul de cupru din complex: [Cu2+(NH3)4]2+.
- când liganzii sunt ioni negativi: sarcina ionului complex se calculează făcând suma sarcinilor ionilor din complex, ținând seama de numărul de coordinare.
Exemplu: în cazul ionului de hexafluorură de fier [Fe F6]3-, sarcina ionului central este (+3), sarcina ligandului este (-1)*6 = (-6), deci sarcina complexului este (+3)+(-6) = (-3).