Legea lui Hess. Entalpia de formare standard.
Tag-uri
Partajeaza in Google Classroom
Teorie: Teorie - Legea lui Hess. Entalpia molară de formare standard. Descarcă PDF
Eliberarea energiei prin încălzirea mediului exterior semnifică o micşorare a entalpiei unui sistem aflat la presiune constantă. Aşadar, sistemul chimic cedează energie şi trece dintr-o stare caracterizată printr-o entalpie mai mare, care este entalpia totală a reactanţilor, HR, într-o nouă stare caracterizată printr-o entalpie mai mică, care este entalpia totală a produşilor, HP. Aşadar, în cazul reacţiilor exoterme:
- HR > HP
- ΔH < 0
Absorbţia energiei prin răcirea mediului exterior semnifică o creştere a entalpiei unui sistem aflat la presiune constantă. Aşadar, sistemul chimic primeşte energie din exterior şi trece dintr-o stare caracterizată printr-o entalpie mai mică, HR, într-o nouă stare, a produşilor de reacţie, caracterizată prin entalpie mai mare, HP. Aşadar, în cazul reacţiilor endoterme:
- HR < HP
- ΔH > 0
Variaţia entalpiei este negativă pentru reacţiile exoterme şi pozitivă pentru reacţiile endoterme.
Legea lui Hess spune că variaţia totală a entalpiei unei reacţii nu depinde de calea care duce la această variaţie, ci depinde numai de starea sa iniţială şi finală. Spre exemplu, pentru o reacţie care are loc în trei etape, legea lui Hess se aplică în felul următor:
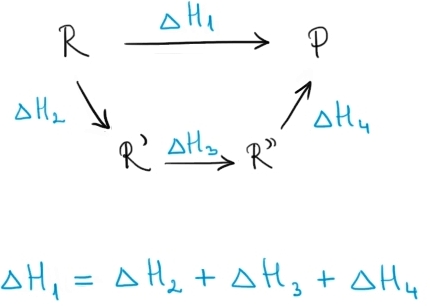
Căldura absorbită sau degajată într-o reacţie chimică este aceeaşi indiferent dacă transformarea are loc într-o singură etapă sau în mai multe.
Condiţiile standard de reacţie sunt următoarele:
- temperatură: 25° C sau 298 K,
- presiune: 1 atm,
- concentraţia soluţiilor: 1M.
Prin convenţie, s-a stabilit ca entalpie de referinţă entalpia substanţelor elementare care, în condiţii standard, este considerată zero.
Entalpia molară de formare standard, ΔHf0, reprezintă cantitatea de căldură degajată sau absorbită atunci când 1 mol de substanţă compusă se formează din elementele constituente. Entalpia molară de formare standard este, de fapt, variaţia entalpiei reacţiei de sinteză a unui mol de substanţă din elementele sale componente care se află în starea lor standard. Se exprimă în kJ/mol.
Legea lui Hess poate fi formulată şi astfel: variaţia de entalpie a unei reacţii este egală cu diferenţa dintre suma entalpiilor de formare a tuturor produşilor de reacţie şi suma entalpiilor molare de formare a tuturor reactanţilor. Această formulare este exprimată matematic prin relaţia de mai jos:
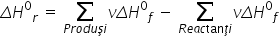
Aplicaţii ale legii lui Hess:
- permite calculul entalpiilor de formare pentru unele substanţe compuse pe care nu le putem obţine direct din elementele componente;
- permite calculul căldurilor de reacţie pentru anumite reacţii care au loc în condiţii periculoase, condiţii în care ar fi imposibil de măsurat practic aceste mărimi.
Cunoscând valoarea entalpiei molare de formare, se poate aprecia stabilitatea substanţelor. Dacă ΔHf0 < 0, atunci reacţia de sinteză a acelui compus din elementele sale componente este o reacţie exotermă. De asemenea, o valoare negativă a entalpiei de formare înseamnă că substanţa este mai stabilă decât elementele sale componente. Aşadar, cele mai stabile substanţe sunt cele care au cele mai mici entalpii molare de formare.






