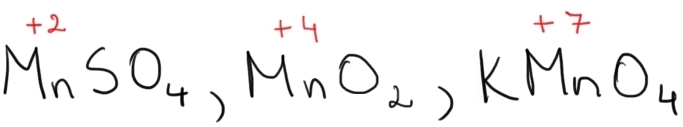Valenţa şi numărul de oxidare - partea II
Partajeaza in Google Classroom
Teorie: Teorie - Valența și numărul de oxidare – partea a II-a Descarcă PDF
Valența și numărul de oxidare – partea a II-a
Determinarea numărului de oxidare în funcție de electronegativitate se poate face conform următoarei reguli:
Numărul de oxidare al unui atom dintr-un compus chimic este egal cu numărul electronilor de valență ai atomului în stare liberă, minus numărul electronilor care sunt mai puternic atrași de atom în moleculă sau în ionul poliatomic.
Exemplu – calculul numerelor de oxidare ale atomilor de H și F din molecula de HF, în funcție de electronegativitate:
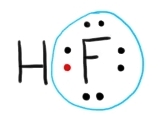
Atomul de F, în stare liberă, are 7 e- de valență. În molecula de HF, H și F pun în comun câte un e- fiecare, deci se formează un dublet de legătură. Fiind mai electronegativ, F atrage mai puternic către el atât electronii din învelișul său de valență, cât și electronul pus în comun de H. Atomul de hidrogen, cu electronegativitatea sa mai scăzută, nu atrage mai puternic nici măcar electronul pe care chiar el îl pune în comun. Așadar, aplicând regula de mai sus, avem următoarele două calcule:
N.O.F = 7 (e- de valență) – 8 (e- atrași mai puternic de F) = -1
N.O.O = 1 (e- de valență) – 0 (e- atrași mai puternic de O) = +1
Determinarea numărului de oxidare în funcție de numărul grupei se poate face ținând cont de numărul electronilor de valență și de calea pe care elementele o aleg pentru a-și atinge configurația stabilă.
1. Grupele principale (1, 2, 13, 14, 15, 16, 17, 18): în cazul primelor două grupe principale, numărul electronilor de valență corespunde cu numărul grupei; în cazul următoarelor 6 grupe principale, numărul electronilor de valență corespunde cu numărul grupei, minus 10.
Elementele care pot forma ioni pozitivi sau ioni negativi au numerele de oxidare egale cu electrovalența elementului.
Un caz aparte sunt elementele grupei a 14-a. C și Si pun electroni în comun atunci când formează molecule cu alte elemente. În majoritatea cazurilor, C și Si au N.O. = +4. Însă C poate avea și N.O. = +2, în cazul moleculei de CO (monoxid de carbon) spre exemplu. Sn și Pb pot ceda electronii de valență. În majoritatea compușilor pe care îi formează, Sn și Pb au fie N.O. = +2, fie N.O. = +4.
2. Grupele secundare: în cazul elementelor din cele 10 grupe secundare, trebuie să ținem cont că electronul distinctiv ocupă un substrat aflat mai în interiorul învelișului electronic, în raport cu ultimul strat. De aceea, elementele din grupele secundare pot folosi ca electroni de valență fie electronii de valență din stratul exterior, fie electronii din stratul în care se află electronul distinctiv (adică ultimul electron care ocupă un orbital). Astfel, aceste elemente pot avea mai multe numere de oxidare în diverși compuși chimici. În general, cu cât numărul grupei secundare e mai mare, cu atât acesta poate avea mai multe numere de oxidare.
Exemplu – Mn poate avea numere de oxidare de la +2 la +7: