Variaţia energiei de ionizare
Partajeaza in Google Classroom
Teorie: Teorie - Variația energiei de ionizare Descarcă PDF
Variația energiei de ionizare
Anionii sunt ioni negativi. Un atom devine anion atunci când primește electroni. Așadar, un anion are un număr de electroni mai mare decât numărul de protoni din nucleu.
Cationii sunt ioni pozitivi. Un atom devine cation atunci când cedează electroni. Așadar, un cation are un număr de electroni mai mic decât numărul de protoni din nucleu.
Exemplu – Formarea ionilor Al3+ și O2-:
13Al: Al – 3 e- 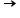 Al3+
Al3+
- Cei 3 e- cedați de Al sunt electronii care se aflau pe ultimul său strat electronic.
- Ionul Al3+ are acum o configurație stabilă de octet, identică cu configurația gazului rar Ne.
8O: O + 2 e- 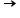 O2-
O2-
- Atomul de oxigen are 6 e- pe ultimul strat electronic. Așadar, pentru a ajunge la o configurație stabilă de octet, atomul de oxigen primește 2 e-.
- Ionul O2- are acum o configurație stabilă de octet, identică cu configurația gazului rar Ne.
Energia de ionizare reprezintă cantitatea de energie necesară pentru a smulge un electron din învelișul electronic al unui atom în stare gazoasă. Rezultatul este obținerea unui cation.
Prima energie de ionizare sau energia de ionizare primară (notată în continuare cu I1) reprezintă cantitatea de energie necesară pentru a smulge electronul cel mai slab reținut de sarcina nucleară a unui atom.
Dacă atomul unui element în stare gazoasă are mai mulți electroni pe ultimul strat, aceștia pot fi și ei smulși din stratul electronic sub influența unei energii de ionzare secundare, terțiare, cuaternare, etc, (I2, I3, I4, etc) în funcție de numărul de electroni care vor fi smulși din învelișul electronic.
Energia de ionizare poate fi energie termică (căldură) și atunci se măsoară în kcal/mol sau în kJ/mol. Energia de ionizare se poate măsura și în electronvolți, eV.
Electronul sau electronii smulși din învelișul electronic al unui atom vor fi preluați de un alt atom sau vor fi împărțiți cu un alt atom în cadrul unei reacții chimice – electronii nu rămân niciodată în aer.
Procesul de ionizare poate fi reprezentat astfel:
Ionizare primară: E(gaz) + I1 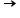 E+ + e-
E+ + e-
Ionizare secundară: E(gaz) + I2 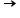 E2+ + 2 e-
E2+ + 2 e-
Ionizare terțiară: E(gaz) + I3 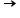 E3+ + 3 e-
E3+ + 3 e-
I1 < I2 < I3
Variația energiei de ionizare primare
- În grupă: energia de ionizare descrește de sus în jos.
- În perioadă: energia de ionizare crește de la stânga la dreapta.
Cele mai scăzute valori ale energiei de ionizare le au elementele situate în colțul din stânga, jos, al tabelului periodic.
Reacția elementelor din grupa 1 cu apa: există o corelație între reacția elementelor cu apa și valoarea energiei lor de ionizare: cu cât energia de ionizare este mai scăzută, cu atât elementul va reacționa mai rapid și mai violent cu apa.
- Cs și H2O reacționează cu explozie;
- K și H2O reacționează cu degajare de căldură (din reacție se va degaja H2 care se aprinde de la sine);
- Na și H2O reacționează tot cu degajare de căldură (apa din vasul de reacție se va încălzi).
Cele mai ridicate valori ale energiei de ionizare le au elementele din colțul dreapta, sus, al tabelului periodic. În cazul unora dintre aceste elemente, energia de ionizare este atât de ridicată încât este greu, sau aproape imposibil ca un electron să fie smuls din înveliș. Aceste elemente preferă să primească electroni pentru a ajunge la o configurație stabilă.






