Variaţia proprietăţilor periodice chimice
Partajeaza in Google Classroom
Teorie: Teorie - Variația proprietăților periodice chimice Descarcă PDF
Variația proprietăților periodice chimice
Proprietățile periodice ale elementelor chimice sunt proprietățile care revin de la o perioadă la alta la elementele din aceeași grupă. Periodicitatea acestor proprietăți se datorează existenței aceluiași număr de electroni în stratul de valență al elementelor din aceeași grupă.
În special în cazul grupelor principale, elementele din aceeași grupă au aceleași proprietăți chimice generale.
Un element chimic poate obține o configurație electronică stabilă de octet sau de dublet, în două feluri:
- Prin transfer de electroni (cedare sau acceptare de electroni);
- Prin punere în comun de electroni (formare de legături chimice covalente).
Electronegativitatea este puterea cu care un element atrage electronii dintr-o legătură covalentă și are valori numerice.
Scara numerică a electronegativității are valori între 0,7 și 4, unde elementul cu valoarea 4 atrage cel mai puternic electronii dintr-o legătură covalentă.
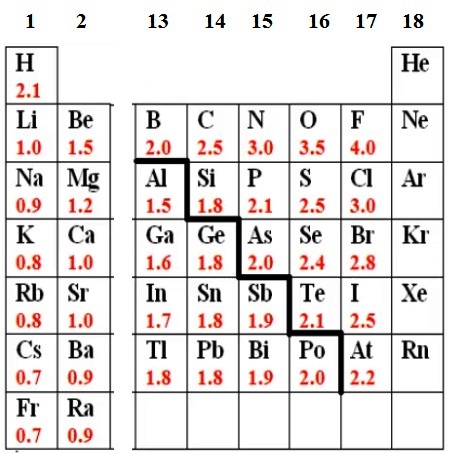
Valorile electronegativităților elementelor din grupele principale conform lui Linus Pauling.
Cei mai electronegativi atomi sunt cei cărora le mai lipsesc 1 e-, 2 e-, sau 3 e- până la configurația de octet. Cele mai mici valori ale electronegativității le au atomii care pot realiza configurația de octet pierzând un singur electron (elementele din grupa 1).
Electronegativitatea are o variație în tabelul periodic similară cu energia de ionizare: cu cât un element este mai electronegativ, cu atât elementul respectiv are o energie de ionizare mai mare.
Variația electronegativității în tabelul periodic:
- crește în perioadă de la stânga la dreapta;
- crește în grupă de jos în sus.
Electropozitivitatea este tendința atomilor de a ceda electroni cu ușurință ( unul, doi sau 3 e-) și a forma ioni pozitivi, pentru a ajunge la o configurație electronică stabilă.
Valența este un număr întreg ce caracterizează capacitatea de combinare a unui atom cu un alt atom. NU este același lucru cu numărul electronilor de valență sau cu numărul stratului de valență. Valența este determinată de numărul electronilor cu care un atom poate participa la o legătură chimică și variază în funcție de element și de poziția acestuia în tabelul periodic.
Valența se poate raporta la reacția elementelor cu hidrogenul sau oxigenul. De exemplu, ilustrând formulele generale ale oxizilor elementelor din grupele principale, se poate observa variația periodică a valenței elementelor.
|
Grupa |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
|
Valența |
I |
II |
III |
IV, II |
V, III |
VI, IV |
VII, V |
|
Oxizi |
E2O |
EO |
E2O3 |
EO2 EO |
E2O5 E2O3 |
EO3 EO2 |
E2O7 E2O5 |
Variația valenței în tabelul periodic:
- crește în perioadă de la stânga la dreapta;
- nu variază în grupă.
Metale și nemetale
În tabelul periodic există trei categorii principale de elemente chimice: metale, nemetale și semimetale (numite și metaloizi).
Nemetalele sunt despărțite de semimetale și metale prin diagonala care pornește în zig-zag de la bor spre poloniu.
|
Caracteristicile metalelor |
Caracteristicile nemetalelor |
|
|
Variația caracterului metalic în tabelul periodic:
- scade în perioadă de la stânga la dreapta;
- crește în grupă de sus în jos.
Caracterul bazic al oxizilor metalici variază la fel ca și caracterul metalic al elementelor.
Variația caracterului nemetalic în tabelul periodic:
- scade în perioadă de la dreapta la stânga;
- crește în grupă de jos în sus.
Caracterul acid al oxizilor nemetalici variază la fel ca și caracterul nemetalic al elementelor.






