Acidul sulfuros, H2SO3, este un acid slab dibazic, cunoscut sub forma sărurilor sale: sulfiții și sulfiții de hidrogen. Acidul sulfuros este un lichid instabil, solubil în apă, incolor, cu o puternică aromă de sulf; derivă din absorbția dioxidului de sulf în apă. Denumirea întreagă este acid trioxosulfuric (IV).
Preparare
Acidul sulfuros se obține prin introducerea dioxidului de sulf în apă. El se cunoaște numai sub formă de soluție apoasă, deoarece se descompune ușor în dioxid de sulf și apă:
H2SO3  H2O + SO2
H2O + SO2
De aceea, soluția de acid sulfuros miroase puternic a dioxid de sulf.
ProprietățiCa și dioxidul de sulf, acidul sulfuros este un reducător puternic, prin faptul că se oxidează ușor trecând în acidul sulfuric:
Astfel, la tratare cu dioxid de sulf sau acid sulfuros (respectiv sulfiți), o soluție violetă de permanganat se decolorează (MnO4- → Mn2+) sau o soluție portocalie de bicromat devine verde (Cr2O72- → Cr3+), iar o soluție galbenă brună de apă de brom se decolorează (Br → Br-).
Reducerea halogenilor de către dioxid de sulf, respectiv acid sulfuros:
este o reacție caracteristică; ea folosește la determinarea calitativă a acidului sulfuros, ca și a dioxidului de sulf.
Acidul sulfuros reacționează cu metalele active, formând sulfiți:
H2SO3 + Mg → MgSO3 + H2
De asemenea reacționează cu oxizi bazici și cu baze trecând în sulfiți.
Sulfiții (sărurile acidului sulfuros) sunt produse importante. Acidul sulfuros fiind un acid dibazic slab:
H2SO3  HSO3- + H+; K1 = 1,6 ⸱ 10-2
HSO3- + H+; K1 = 1,6 ⸱ 10-2
HSO3-  SO32- + H+; K2 = 1,0 ⸱ 10-7
SO32- + H+; K2 = 1,0 ⸱ 10-7
de la el derivă două serii de săruri: sulfiți acizi, adică sulfiți de hidrogen și un metal, MIHSO3, și sulfiți neutri, M2ISO3.
Sulfiții acizi (numiți înainte și bisulfiți) sunt solubili în apă; unii există numai în soluție apoasă, de exemplu sulfitul acid de calciu, Ca(HSO
3)
2, folosit la obținerea celulozei (sub numele de leșie bisulfitică), sau sulfitul acid de sodiu, NaHSO
3, întrebuințat în industriile textile (ca reducător în vopsitorie și decolorant).
Sulfiții neutri sunt greu solubili în apă, cu excepția sulfiților alcalini și a sulfitului de amoniu.
În soluție apoasă, sulfiții se oxidează ușor la sulfați; de aceea trebuie păstrați în vase perfect închise. Prin reducere, ei trec în ditioniți (hiposulfiți), M2IS2O4.
Acidul sulfuros fiind un acid slab, sulfiții reacționează cu acizii tari, de exemplu cu acidul clorhidric:
CaSO3 + 2HCl → CaCl2 + H2O + SO2
(de fapt, rezultă acid sulfuros, care însă se descompune).
Sulfiții alcalini, singurii sulfiți solubili, se prepară prin tratarea cu dioxid de sulf a soluțiilor apoase sau a suspensiilor de hidroxizi sau carbonați alcalini. Sulfiții insolubili se obțin prin reacții de dublu schimb între sulfiți alcalini și săruri solubile ale unor metale.
Dintre sulfiți, importanți sunt sulfitul de sodiu, Na2SO3, și sulfitul de potasiu, K2SO3.
Deși acidul sulfuros liber nu a fost izolat, i se atribuie două formule de structură, izomere:
de la care derivă același ion
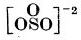
. Ionul SO
32- are structură de piramidă, cu baza triunghiulară și atomul de sulf în vârf.
Cele două forme ale acidului sufluros, deși sunt inseparabile, formează două serii de esteri organici.
În acidul sulfuros, atomul de sulf mai posedă o pereche de electroni neparticipanți, ceea ce este caracteristic atomilor care au numărul de oxidare mai mic cu doi decât numărul lor maxim de oxidare.
 H2O + SO2
H2O + SO2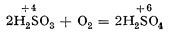
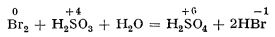
 HSO3- + H+; K1 = 1,6 ⸱ 10-2
HSO3- + H+; K1 = 1,6 ⸱ 10-2 SO32- + H+; K2 = 1,0 ⸱ 10-7
SO32- + H+; K2 = 1,0 ⸱ 10-7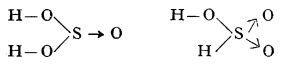
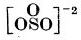 . Ionul SO32- are structură de piramidă, cu baza triunghiulară și atomul de sulf în vârf.
. Ionul SO32- are structură de piramidă, cu baza triunghiulară și atomul de sulf în vârf. 





