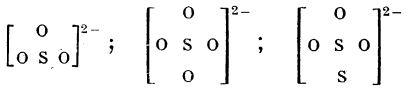Preparare
Deși foarte instabil, acidul tiosulfuric rezultă prin sinteză din trioxid de sulf și hidrogen sulfurat, în soluție eterică:
H2S + SO3  H2S2O3
H2S2O3
Sau prin tratarea unor tiosulfați cu acid clorhidric:
S2O32- + 2H+  H2S2O3
H2S2O3
Dintre sărurile acidului tiosulfuric - tiosulfații - se cunosc numai cei neutri, M2IS2O3, care sunt stabili. Ei se obțin fierbând sulfiții cu sulf:
SO32- + S → S2O32-
Reacție analogă cu oxidarea sulfiților la sulfați:
SO3- + O → SO42-
După altă metodă industrială, tiosulfații se prepară prin oxidarea polisulfurilor cu oxigenul atmosferic sau cu un oxidant slab:
2Na2S2 + 2O2 → 2Na2S2O3
Tiosulfații metalelor alcaline sunt substanțe stabile, ușor solubile în apă; din soluție cristalizează sub formă de hidrați cristalini. Tiosulfații metalelor grele formează complecși.
Prin tratarea soluțiillor apoase ale tiosulfaților cu un acid rezultă dioxid de sulf și sulf. Intermediar se formează acid tiosulfuric:
S2O32- + 2H+ → H2S2O3 → H2O + SO2 + S
Tiosulfatul de sodiu cristalizează în cristale incolore, Na2S2O3 ⸱ 5H2O. El este solubil în apă, dizolvarea fiind însoțită de absorbție de căldură.
Caracteristică este reacția lui cu iod, când trece în tetrationat de sodiu:
2S2O32- + I2 → S4O62- + 2I-
Tiosulfatul de sodiu are multe întrebuințări; de exemplu folosește la îndepărtarea clorului din țesăturile albite cu clor:
S2O32- + 4Cl2 + 5H2O → 2HSO4- + 8HCl
De aceea, tiosulfatul de sodiu se mai numește și anticlor. De asemenea este utilizat în fotografie pentru îndepărtarea bromurii de argint neatacate de lumină de pe placa fotografică (fixator). În consum, tiosulfatul de sodiu mai este denumit în mod greșit hiposulfit de sodiu.
În molecula ionului tiosulfat cei doi atomi de sulf nu sunt echivalenți. Comparând structura ionilor: SO32-, SO42- și S2O32-
se observă că ionul S2O32- se deosebește de ionul SO32- prin adiția unui atom de sulf. Prin urmare, trecerea ionului sulfit în ionul sulfat este un proces de oxidare. Înainte, acidul tiosulfuric era considerat a fi un produs de reducere a acidului sulfuros, de unde și numele lui impropriu de “acid hiposulfuros”. Acidul hiposulfuros, este acidul ditinos, H2S2O4, ale cărui săruri, ditioniții (hiposulfiții), se pot obține prin reducerea sulfiților:
2SO32- + 2e- + 4H+ → S2O42- + 2H2O
De asemenea, comparând structura celor trei ioni de mai sus, se observă că ionul SO42- se deosebește de ionul S2O32- prin înlocuirea unui atom de oxigen cu un atom de sulf. (Deoarece prin prefixul tio se arată că sulful a înlocuit oxigenul într-o combinație, numele corect al compusului este acid tiosulfuric.) Atomul de sulf central are numărul de oxidare +6, iar atomul de sulf legat, numărul de oxidare -2 (ca și atomii de oxigen).
 H2S2O3
H2S2O3 H2S2O3
H2S2O3