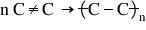Alchene – proprietăţi chimice
Partajeaza in Google Classroom

Transcript
știm deja că alchenele sunt hidrocarburi
nesaturate care conțin o legătură
dublă și mai știm că o legătură
dublă e formata dintre o legătură
Sigma și o legătură Pi legăturile
fii sunt cu mult mai instabile
decât legăturile Sigma Deci legăturile
duble și legăturile triple se pot
rupe destul de ușor fac care explică
reactivitatea mare al genelor și
altul compuși organici care conțin
astfel de legături alchenele pot
participa la reacții prin care
se rupe numai legătura pi sau la
reacții care au loc cu ruperea
totală a dublei legături astfel
de reacții sunt adiția oxidarea
și polimerizarea acestea sunt reacții
specifice a legăturii duble adică
reacții specifice pentru hidrocarburile
nesaturate alchenele participă
și la reacții de ardere și de substituție
atâta sunt reacții comune cu cele
ale alcanilor pentru alchenă sunt
admitere legături care au energii
de legătură mai mici adică sărut
mai ușor atâtea sunt legătura pi
din legătura dublă după cum am
mai zis și legătura dintre atomul
de carbon hibridizat sp3 care a
mai zis data trecută că se numește
iliric și hidrogenul din poziția
vecină legături duble aceasta se
numește poziția lirică de ce stă
două legături se rupe mai ușor
reacțiile de adiție de polimerizare
și de oxidare au loc la legătura
dublă iar reacțiile de substituție
au loc la buzita alini că reacția
ediție este o reacție specifică
legături duble În această reacție
se rupe numai legătura pi astfel
se formează câte o legătură Sigma
la fiecare atom de carbon participa
la legătura dublă momentul în care
se pot insera în moleculă invers
și alții atom între cei doi atomi
de carbon rămâne o legătură Sigma
cea mai simplă reacție de adiție
este adiția hidrogenului sau hidrogenarea
reacție presupune ediție a unei
molecule de hidrogen la o alchenă
în urma acestei reacții de hidrogenare
obținem alcani corespunzător pentru
a putea face asta avem nevoie de
catalizator metalici precum Nicol
platină sau palladium de temperaturii
între 80 și 180 de grade Celsius
și depresiuni indicate de până
la 200 de ani mosule avem nevoie
de aceste condiții de reacție pentru
a desparti cei doi atomi de hidrogen
din molecula de hidrogen legătura
dintre ei fiind foarte puternică
dar după ce se întâmplă asta atomii
de hidrogen se leagă rapid de alchenă
Și ați formând legătura dublă într
o legătură simplă în acest exemplu
am obținut etaj prin hidrogenarea
a etenei mai sunt și alte molecule
care pot la legătura dublă obținem
compușii halogenați în care cei
doi atomi de halogen sunt învecinați
acești compuși se numesc derivat
halogenat vicinali aceasta este
reacția de halogenare dintre clor
și iod cel mai ușor se ia de ce
clorul apoi bromul și cel mai greu
se decernează iodul hidracizii
adică acidul clorhidric bromhidric
și achiziționează la alchene formând
derivat monohalogenat în reacția
de adiție cel mai reactiv dintre
hidracizi este acidul iod ma de
acidul bromhidric iar cel mai puțin
reactive este acidul clorhidric
pentru adiția acidului clorhidric
la alchene avem nevoie de prezența
unor catalizator pe cu un clorura
de mercur sau clorura de fier prin
reacția de adiție dintre Atena
și gras Mitric obținem bromoetan
ul adică derivatul monohalogenat
saturat al etena de cei doi atomi
de carbon participanți la dubla
legătură este legat un număr egal
de atomi de hidrogen Avem doi atomi
de grajd aici și 2 la acest atom
Așadar spunem că Ana este o alchenă
simetrică însă Spre exemplu în
cazul Plopeni lucrurile stau diferit
vedem că acest atom de carbon se
leagă de doi atomi de hidrogen
iar acesta de un singur atom de
hidrogen alchinele în care cei
doi atomi de carbon din dubla legătură
se leagă de un număr diferit de
atomi de hidrogen sunt alchenei
asimetrice în acest caz adiția
hidracizilor este orientată sau
Regio selectivă chimistul Rus Vladimir
Marco Este cel care a studiat mecanismul
acestei react nikova observat că
atomul de hidrogen din molecula
hidra acidului se fixează la atomul
de carbon care are cel mai mare
număr de atomi de hidrogen iar
atomul de halogen se fixează la
atomul de carbon al duble legături
care are numărul mai mic de atomi
de hidrogen obținem tot un derivat
monohalogenat saturat această regulă
se numește regula lui markovnikov
să luăm exemplul adiția acidului
clorhidric ne interesează cei doi
atomi de carbon participanți la
dubla legătură conform regulii
markovnikov atomul de brom se va
fixa de acest atom de carbon arată
unde hidrogeni si va fixa de acest
atom de carbon si am obtinut astfel
2 bromo 2 metil propan adiția apei
la alchine are loc în prezența
acizilor tari precum acidul sulfuric
concentrat acidul clorhidric Brick
sau acidul azotic aceștia ce stare
au rol de catalizator produșii
de reacție sunt alcoolii largă
nesimetrice adiția apei se face
tot conform regulii lui markovnikov
atomul de hidrogen se fixează de
carbonul care are mai multe atom
de hidrogen iar Gruparea hidroxil
se leagă de atomi de carbon din
legătura dublă care are mai puțini
atom distruge în acest caz este
polimerizarea lichenilor polimerizarea
este procesul prin care un număr
mare de molecule aleagă între ele
și formează o masă moleculă adică
un polimer alchinele se pot Uni
între ele și formează macromolecule
compuse din unități identice care
se repetă de zeci sute sau chiar
de mii de ori polimerizare alchenelor
este ca o reacție de poliție se
rupe legătura pi din fiecare alchina
ce se formează noi legături Sigma
carbon carbon este numărul de molecule
de măr care formează polimerul
și se numește grad de polimerizare
de exemplu prin polimerizarea etenei
obținem polietilenă între paranteze
scrie monomerul care se repetă
de en prin polimerizarea clorurii
de vinil obținem policlorura de
vinil pe scurt PVC denumirile care
Sigur vă sună familia polimeri
care se obțin din etenă sau din
etena substituită Cum este clorura
de vinil se numesc polimeri Cu
toții ne folosim de polimeri vinilici
în viața noastră de zi cu zi de
exemplu aceste cutii de plastic
sau făcută din polietilenă din
pvc sunt făcute de diverse instalații
și țevi iar din poliacrilonitril
obținem blănuri sintetice și pături
și alte materiale sintetice cu
rezistență mare si acestea sunt
doar câteva exemple în continuare
Haideți să vedem ce presupune reacția
de oxidare A alchenelor ok Daria
genelor poate fi oxidare blândă
sau oxidare energică în funcție
de condițiile de reacție prin oxidarea
alchenelor cu soluție apoasă de
permanganat de potasiu în mediu
bazic la rece obținem niște compuși
organici care sau în condițiile
foarte multe reacții din chimie
organică au loc la temperaturi
de câteva sute de grade temperatura
camerei e considerată o temperatură
scăzută Deci la rece nu înseamnă
temperatură apropiate de 0 grade
și mai degrabă temperaturi apropiate
de temperatura camerei diolii sunt
compuși care conțin două grupări
hidroxi aceasta este oxidarea blândă
de exemplu prin oxidarea blândă
a 2 butenei în prezență de permanganat
de potasiu în mediu bazic obținem
2 3 butanediol oxidarea energică
a alchenelor se face cu dicromat
de potasiu în mediu acid adică
în prezență de acid sulfuric concentrat
sau oxidarea energică se mai poate
face cu permanganat de potasiu
tot în mediu acid Am văzut că în
cazul oxidării blând se formează
diode Deci rupe doar legătura pi
însă între atomii de carbon participant
la dublă mai rămâne o legătură
în cazul oxidării energice se rupe
complet legătura dublă carbon carbon
și se formează amestecuri de diferiți
produs de oxidare care depinde
structura inițială l cheie dacă
atomul de carbon din dubla legătură
este legat de un atom de hidrogen
ce formează un acid carboxilic
grupa funcțională c o h are această
structură iar aceasta este formula
generală a unui acid carboxilic
de carbon implicată legătura dublă
care se află la capătul unei catene
De ce are doi atomi de hidrogen
Se oxida până la deal și de carbon
și apă dacă atomul de carbon implicat
în legătura dublă este legat de
niciuna domnit și trojan atunci
se formează un compus carbonilic
Adică o cetonă structura grupe
funcționale carbonil este aceasta
carbon de g tură dublă oxigen celălalt
atom de carbon are doi atomi de
hidrogen Deci se oxidează până
la dioxid de carbon și apă în toate
aceste exemple R și R prim pot
fi radicali alchil identici sau
diferiți să luăm exemplul 2 butenei
prin oxidare energică cu permanganat
de potasiu în mediu acid obținem
două molecule de acid acetic ambii
atomi de carbon participanți la
legătura dublă sunt legați de câte
un atom de hidrogen în cazul oxidării
energice a 2 metil 2 butenei obținem
o moleculă de acetonă Deci aceasta
la Gruparea carbonil specifică
cetonelor și obținem și o moleculă
de acid acetic reacțiile de substituție
nu sunt caracteristice alchenelor
hidrocarburilor saturate precum
ascunse după cum am precizat la
începutul lecției atomii de hidrogen
legați de un atom de carbon din
poziția lirică adică poziția vecină
duble legături cel mai reactiv
decât atomi de hidrogen de la ceilalți
atomi de carbon din Catena astfel
lapte Bradul indicate între 500
și 600 de grade Celsius are loc
substituții atomilor de hidrogen
din poziția lirică What om de clor
sau bro de exemplu prin tratarea
propenei cu clor la acest sută
de grade Celsius obținem propena
compuse care se mai numește uzual
și clorură de alun clorura de alil
e folosită pentru obținerea industrială
a glicerinei compuse de care ai
auzit Cu siguranță acestea sunt
cele mai importante reacții la
care participă altele observăm
că aplicațiile practice ale compușilor
organici observăm că aplicațiile
practice ale compușilor organici
sunt din ce în ce mai diversele
viitoare vom discuta și despre
compușii care au în structura lor
mai mult de o legătură dublă sau
chiar o legătură triplă