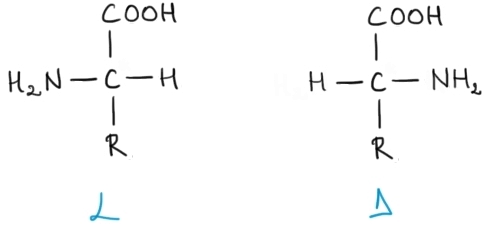Aminoacizi
Tag-uri
Partajeaza in Google Classroom

Transcript
patinele sunt o clasă de molecule
care au aproape o infinitate de
puncte în organismele vii sunt
extrem de variate pentru o singură
celulă putem da peste câteva mii
de proteine există niște subunități
monomeri ție relativ simple care
ne oferă cheia către structura
a mii de proteine diferite e vorba
bineînțeles de aminoacizi toate
proteinele provine de la cele mai
antice bacterii sau de la cele
mai complexe de forme de viață
sunt formate din aceeași douăzeci
de ani în noua ci proteinele se
găsesc în romb are varietatea de
dimensiuni de la ppd relativ mici
formate din numai câteva resturi
de aminoacizi și până la polimeri
mei și formați din câteva mii de
ani marca bine este faptul că celulele
pot produce proteine cu proprietăți
și funcții extrem de diferite din
aceeași 20 de aminoacizi organismele
vii pot construi din cei 20 de
ani nu produși precum enzime hormoni
articol transportatori pânze de
păianjen unghii păr blond și mii
de alte substanțe cu puncte biologice
variațiile roșii din sânge care
conține o globina luteina care
transportă oxigen Toate aceste
substanțe sunt de natură proteică
deci sunt formate din aminoacizi
după cum știm deja proteinele sunt
polimeri a aminoacizilor polimeri
care se formează pentru o reacție
de policondensare a aminoacizilor
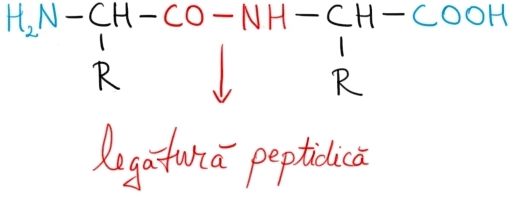
cu fiecare rest de aminoacizi God
de vecinul său pentru o legătură
covalentă specifică numită legătură
pe fizică termenul rest de aminoacid
e folosit pentru a scoate în evidență
faptul că prin reacția de condensare
între doi aminoacizi se pierde
o molecule de apă Câte inele pot
fi descompuse sau hidrolizate la
aminoacizi constituenți pentru
o varietate bineînțeles primele
Studii asupra proteinelor sau concentrat
asupra aminoacizilor izolați din
diverse puțini au trecut exact
132 de ani până când sau descoperit
toți cei 20 de aminoacizi naturali
care se găsesc în proteine primul
a fost descoperit în 1806 iar ultimul
avion 1938 lecții aceasta vom discuta
despre informațiile pe care le
aflat oamenii de știință studiind
aceștia animații cei 20 de aminoacizi
naturali Au în comun anumite caracteristici
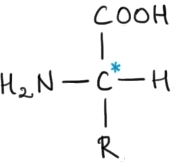
structurale toți sunt alfamino
adică au grupa carboxil și grupa
Nyno legate de același atom de
carbon carbonul Alfa poziția Alfa
este poziția vecină grupe carboxil
aceasta e poziția Beta gamă și
tot așa deci acesta ar fi un Betta
aminoacid Așadar aminoacizi din
proteine sunt alfamino aci diferă
între ei prin catenelor laterale
adică prin radicalii Istru carbonat
pe care notăm cu aer mai pe scurt
aceeași ridicand intru carbonat
au structuri dimensiuni și sarcini
electrice variate și influențează
solubilitatea în apă a fiecărui
aminoacid în parc pe lângă aceeași
20 de aminoacizi naturali mai există
și alții mai puțin comun dar noi
nu vom discuta despre ei în cazul
tuturor aminoacizilor naturali
cu excepția glicinei carbonul Alfa
a legat de patru grupuri diferite
de atomi grupă carboxil o grupa
Amino o grupă aer și un atom de
hidrogen aceasta este formula generală
a unui aminoacid în cazul glicinei
radicalul hidrocarbonat este de
fapt doar un atom de hidrogen Așadar
în toți aminoacizii cu excepția
glicine atomul de carbon din poziția
asta este un centru de calitate
despre realitate am discutat în
lecțiile dedicate izomerilor cele
patru grupuri diferite din structura
aminoacizilor ocupă două aranjamente
spațiale unice si astfel pentru
aminoacizi Este posibilă existența
Ei numai doi stereoizomeri deoarece
acești doi stereoizomeri au în
centru de calitate și se prezintă
ca obiect și imaginea în oglindă
ne superpozabile sunt de fapt enantiomeri
o categorie asteroizilor amintim
și că toate moleculele care au
în centru Deci realitate sunt active
Optic adică rotesc planul luminii
polarizate cu puține excepții în
Alfa aminoacizi naturali atomul
de carbonat Simetric din poziția
Alfa are configurația ei în formulele
de proiectie grupa mănăstire atomul
de hidrogen în dreapta însă de
data aceasta nu ne vom folosi de
sistemul RS pentru a specifica
configurația atomilor din jurul
Centrului de tirani tot configurațiile
zaharurilor simple și ale aminoacizilor
co specificate prin sistemul de
sistem dezvoltat tot de Emil Fischer
prin convenții sa decis că alfamino
acizi naturali fac parte din seria
sterică n iar enantiomerilor din
seria de Așadar vom prezenta întotdeauna
e la kilometrul el cu grupa Amino
în partea stângă și cu atomul de
hidrogen în dreapta și de nu au
nicio legătură cu distruge și le
vedere deoarece nu există nicio
legătură între configurația atomului
de carbon asimetric și sensul în
care este rotit planul luminii
polarizate Aproape toți compușii
biologici cu un centru de realitate
găsesc sub forma unui singur stero
izomeri elfi după cum am precizat
și mai înainte resturile de aminoacizi
din proteine se găsesc exclusiv
sub formă de stiri Marian când
oamenii de știință vor să obțină
compuși tirani în laborator prin
reacții chimice obișnuite rezultatul
un amestec racemic de enantiomeri
el și pe Aceștia sunt foarte dificil
de diferentiat și de separare pentru
un organism viu izomerii deși el
sunt diferit așa cum dreapta e
diferită de stânga celulele sintetizează
numai izomerii ele aminoacizilor
deoarece reacțiile de sinteză sunt
catalizate de enzime iar zidurile
active ale enzimelor sunt asimetrice
de aceea spunem că reacții catalizate
de enzime sunt reacții Stelyos
specifice rezultatul nu e un amestec
la Ce e mic și un stereoizomer
specific după cum bine știm în
moleculele aminoacizilor există
atât o grupă funcțională carboxil
cât și o grupa funcțională Amino
acesta fiind principalul Factor
care determină comportarea cheme
după carboxil care are caracter
acid cedează un Proton grupei Amino
care are caracter bazy dupa mii
nouă fixează protonul o pereche
de electroni neparticipanți de
la atomul de azot pentru o legătură
covalentă coordinativă în urma
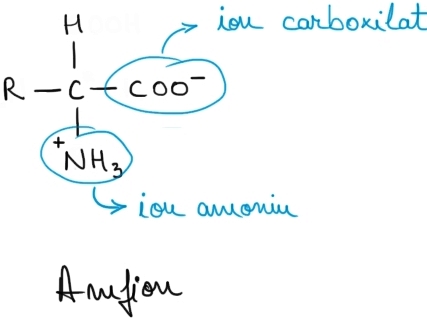
acestui schimb de protoni grupa
carboxil e transformată ionul carboxilat
iar Groupama Noe transformată în
ionul amoniu substitui echilibrul
e deplasat în totalitate spre dreapta
acesta Ioan format prin ionizare
a intra în moleculară a unui aminoacid
conține după cum vedem atât o sarcina
negativă cât și o sarcină pozitivă
și se numește amfioni sau formă
de polară pentru a înțelege biochimia
esențial să cunoaștem proprietățile
chimice ale celor 20 de ani Luis
naturale pentru asta e foarte Cum
să studiem cei 20 de aminoacizi
în cinci categorii principale bazată
pe proprietățile radicalilor hidrocarbonați
din structura lor în special polaritatea
radicalilor carbonat Este foarte
importantă adică tendința de a
interacționa cu apa la pe HBO Logi
pe hașuri biologie fiind aproximativ
pe H categorie este cea aminoacizilor
cu radicali nepolari vedem că radicali
hidrocarbonat din această categorie
sunt nepolari hidrofob alanina
valina leucina izoleucina au tendința
de a forma aglomerări în interiorul
proteinelor stabilit în structura
proteică prin interacțiunile hidrofobe
după cum a zis și mai devreme glicina
are structura cea mai simplă prolina
după cum vedem are o catenă laterală
le fatică cu structură ciclică
regiunile din proteină care conțin
restul de pe Alina au flexibilitate
structurală mai redusă din cauza
aceste catenele laterale acum vine
a doua categorie formată din aminoacizi
care au catenele laterale aromatice
fenilalanina tilozina și triptofanul
sunt relativ nepolare sau hidrofobe
toți trei aminoacizi pot participa
în interacțiuni Foxi la tinei poate
forma legături de hidrogen lucru
foarte important atunci când tilozina
a se află în structura unei enzime
în a treia categorie avem aminoacizii
a căror catenele laterale sunt
radicali intru carbonați polari
fără sarcină electrică radicali
acestora aminoacid sunt puțin mai
solubil în apă adică mai drawful
decât cea a aminoacizilor nepolari
această creștere a solubilității
iar datorită grupelor funcționale
care pot forma legături de hidrogen
cu apa avem aici Serena 3-a nanae
cisteina asparagina și glutamina
la calitatea serinei și teorii
Nae contribuie hidroxil cisteina
are o grupă sulfhidric care e un
acid slab și poate forma legături
de hidrogen cu oxigenul sau azi
iar asparagina și glutamina au
câte o grupare Amino umplut câte
un atom de oxigen carbon iei a
patra categorie conține aminoacizi
care au catenele laterale cu sarcină
pozitivă adică cu caracter bazic
radicalii cei mai faini sunt cei
care au fi sarcina negativă fi
sarcină pozitivă aminoacizi care
7-a o sarcină pozitivă semnificativă
sunt mecena arginina și histidina
sarcină pozitivă le Cine e datorată
celei de a doua grupari Amino din
structura moleculei și ultima categorie
o reprezintă aminoacizii cu radicali
cu sarcina negativă adică cu caracter
acei 2005 care la pe H7 au sarcina
negativă sunt acidul aspartic și
acidul gluten ambii aminoacizi
mai au câte o grupă carboxil o
altă caracteristică chimică foarte
importantă a aminoacizilor este
faptul că ei pot reacționa ca 5
cât și ca bază după cum am văzut
aminoacizii au structură de polară
de afion în care se află atât o
grupă cu caracter bazic eu nu carboxilat
cât și o grupă cu caracter acid
ionul amoniu și de aceea aminoacizii
4y acționăm atât cacii cât și ca
baze având Deci caracter amfoter
observăm că în soluții bazice aminoacizii
se află sub formă de anion iar
în soluția acidă sub formă de con
dacă tratăm o soluție apoasă a
unui aminoacid cum ar fi glicina
cu o cantitate mică din un acid
tare sau cu o cantitate mică de
bază tare atunci Soluții aminoacidului
nu își modifică semnificativ pe
soluțiile care prezintă această
proprietate se numesc soluții tampon