Apa
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Punctul de solidificare și căldura latentă de solidificare a apei
Punctul de fierbere și căldura latentă de vaporizare a apei
Conductibilitatea electrică
Constanta dielectrică
Apa este un lichid incolor, inodor și fără gust care e esențial tuturor formelor de viață și care este un solvent excelent pentru o diversitate mare de substanțe. Apa este un compus chimic al oxigenului și hidrogenului numit oxid de hidrogen, și are formula chimică H2O.
Răspândire în natură
Apa este una dintre cele mai răspândite substanțe din natură, mai ales în stare lichidă - formă care acoperă mai mult de două treimi din suprafața globului, alcătuind apele de suprafață.
Dacă în atmosfera saturată cu vapori de apă intervine o scădere de temperatură, o parte din vapori se condensează și iau forma de nori, ceață, polaie, zăpadă, grindină; în timpul nopților răcoroase din anotimpurile călduroase se depune rouă, iar când temperatura solului este sub 0°C, se depune brumă. Toate acestea formează apele meteorice.
Apele căzute pe pământ sau rezultate din topirea zăpezilor, o parte umplu din nou lacurile, râurile, fluviile, mările și oceanele, iar o parte străbat prin straturile de pământ la adâncimi diferite, formând apele freatice. Dacă în calea lor întâlnesc un strat impermeabil, cum ar fi un strat de argilă, ele se adună acolo și formează apele subterane. Dacă apele subterane, circulând prin diferite straturi, se apropie din nou de suprafață și ies din pământ, se formează izvoarele naturale.
În natură nu există apă chimic pură. Apele naturale conțin cantități variate de diferite substanțe dizolvate. Când conțin numai cantități mici de săruri dizolvate se numesc ape moi, spre deosebire de apele care conțin dizolvate cantități mari de săruri, mai ales de calciu și magneziu, și care se numesc ape dure.
Apa de ploaie este cea mai curată dintre toate apele naturale. Fiind însă în contact prelungit cu aerul, ea conține dizolvate componentele acestuia, precum și diferite impurități din aer, ca de exemplu: dioxid de carbon, amoniac, acid azotic, iar în regiunile industriale sau ale orașelor mari, dioxid de sulf, hidrogen sulfurat, etc.
Apele subterane au compoziția cea mai variată dintre toate apele naturale; cantitatea și natura substanțelor dizolvate depind de natura straturilor de pământ străbătute și de timpul cât apele au fost în contact cu ele. Apele subterane care conțin dizolvate cantități mai mari de diferite substanțe solide sau gazoase, ajungând la suprafață formează izvoarele de ape minerale.
- acide (când conțin mult dioxid de carbon),
- alcaline (când conțin carbonat acid de sodiu),
- sărate (când conțin clorură de sodiu),
- amare (când predomină conținutul de sulfați de magneziu și de sodiu),
- sulfuroase (când conțin sulfuri alcaline),
- iodurate, arsenicale, feruginoase, etc.
Dacă diferite ape reziduale, ca cele de la canalele de scurgere, de la abatoare, fabrici de zahăr, de amidon, de celuloză, etc, ce conțin substanțe de natură vegetală și animală, sunt conduse în râuri sau în ape stătătoare, atunci, mai ales vara, are loc un proces de putrefacție. Însă, bacteriile existente în apă pot descompune materiile organice, transformându-le în dioxid de carbon și apă, proces cunoscut sub numele de autopurificarea apei. Așa se explică de ce apele râurilor mari, deși în ele se varsă apele de canal ale orașelor populate, la o distanță de numai câțiva kilometri de oraș nu mai conțin impuritățile introduse.
Apa mărilor are un conținut de săruri de 11-25 g/l, iar a oceanelor de 32-38 g/l. Concentrația de săruri este cu mult mai mare în mările închise; de exemplu, în cazul Mării Moarte, concentrația sărurilor este atât de mare, încât viața nu poate exista.
Purificarea apelor
După scopul folosirii ei, apa trebuie să îndeplinească anumite condiții de puritate.
Apa potabilă
Pentru a fi bună de băut, apa trebuie să fie limpede, incoloră, fără miros, să aibă temperatura de 7-11°C, să fie lipsită de substanțe în putrefacție și de bacterii patogene; trebuie să conțină însă dizolvate cantități mici de săruri, mai ales de clorură de sodiu și carbonat acid de sodiu (până la circa 600 mg/l) și să fie aerisită, adică să conțină oxigen. (Apa chimic pură, pe lângă gustul neplăcut, are și o acțiune dăunătoare asupra organismului.) Cele mai bune ape potabile sunt ale izvoarelor de la munte, pentru că sunt bine aerisite și lipsite de impurități. Deoarece cele mai multe orașe sunt însă alimentate cu apă de râu, aceasta trebuie în prealabil purificată. Există diferite procedee de purificare:
Sedimentarea se face pentru depunerea prin decantare a impurităților în suspensie. Particulele fine, care nu se separă direct prin sedimentare, sunt precipitate, în mare măsură, prin introducerea de "coagulanți", cum sunt sărurile de aluminiu, de fier, de cupru, gelul de silice, argila feruginoasă tratată în prealabil cu acid sulfuric etc. De exemplu, sulfatul de aluminiu, în prezența carbonatului acid de calciu din apă, trece în hidroxid de aluminiu:
care, fiind gelatinos antrenează în căderea sa particulele de impurități în suspensie.
Apa decantată după sedimentare este trecută la filtrare.
Filtrarea se face trecând apele prin straturi de pietriș și nisip, care rețin aproape toate impuritățile. Microorganismele vii, reținute într-un strat fin la suprafața nisipului, formează cu timpul așa-numita membrană biologică, care reține apoi impuritățile cele mai fine și mai ales microorganismele din apă.
Sterilizarea are drept scop purificarea apei din punct de vedere biologic, adică îndepărtarea completă a germenilor patogeni și reducerea conținutului de bacterii. Aceasta se poate face prin tratare cu clor (0,1-0,3 g Cl/m3 apă), ozon sau iradiere cu raze ultraviolete.
Apele industriale
Prin ape industriale se înțeleg apele destinate diferitelor exploatări industriale: pentru alimentarea cazanelor de abus, pentru răcirea mașinilor, pentru încălzire, precum și pentru diferite procese de fabricație.
Dintre toate apele folosite în diferite industrii, în special apele necesare alimentării cazanelor de abur trebuie să îndeplinească anumite condiții de puritate. Acizii liberi din apă, de exemplu acidul carbonic provenit prin descompunerea carbonaților acizi de calciu și de magneziu sau acidul clorhidric format prin reacția clorurii de magneziu cu apa, oxigenul dizolvat, și rămășițele de uleiuri și alte substanțe, atacă pereții cazanelor. De asemenea, apa de alimentare nu trebuie să fie dură ca să nu depună piatră.
Piatra de cazan este formată din substanțele minerale greu solubile din apă, mai ales carbonați de calciu și de magneziu și sulfat de calciu, care, în timpul vaporizării apei din cazane, se depun pe pereții acestora sub forma unpr incrustații. Piatra depusă împiedică transmiterea căldurii și de aceea mărește consumul de combustibil necesar vaporizării apei. De exemplu, un strat de piatră de cazan de 3 mm grosime necesită un consum de combustibil mărit cu 20%. De asemenea, încălzirea cazanului nemaifiind uniformă, pereții nu se dilată uniform, ceea ce poate provoca fisuri sau chiar explozia cazanului.
De aceea, înainte de intrarea apei în cazan se înlătură din ea substanțele care formează piatra. Această operație, numită dedurizare, se poate realiza prin diferite procedee, în funcție de gradul de duritate al apei (vezi Duritatea apei).
Și apa folosită în alte industrii trebuie să îndeplinească anumite condiții de puritate, care depind de specificul industriei în care este utilizată. Astfel, de exemplu, apa care este necesară la prepararea amoniacului sau a acidului clorhidric trebuie să fie perfect pură; apa întrebuințată în industria zahărului trebuie să îndeplinească condițiile unei ape potabile, iar duritatea ei să fie cât mai mică, deoarece conținutul de săruri înrăutățește procesul de cristalizare a zahărului; la fabricarea berii, calitatea apei folosite are o importanță deosebită, deoarece determină gustul berii; în spălătoriile textile trebuie folosite ape cu duritate foarte scăzută, deoarece sărurile de calciu și magneziu, la spălare cu săpun, formează săpunuri insolubile în apă, care murdăresc țesăturile, etc.
Purificarea apei se face prin diferite procedee.
Distilarea, care are ca scop îndepărtarea substanțelor dizolvate, constă în fierberea apei urmată de condensarea vaporilor.
În laborator, distilarea se face într-un balon de sticlă prevăzut cu un tub lateral introdus într-un refrigerent:
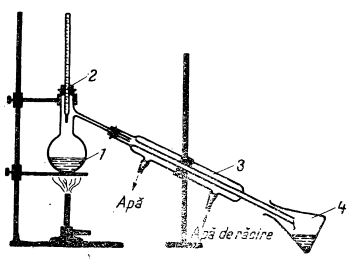
1 - balon cu apă impură;
2 - dop cu termometru;
3 - refrigerent;
4 - vas de colectare.
Apa distilată se colectează într-un vas, iar impuritățile rămân în balonul de distilare. Pentru distilarea unor cantități mai mari de apă se folosește distilatorul, un cazan metalic, al cărui capac este prevăzut cu un tub în spirală așezat într-un vas răcitor prin care circulă apă rece. Vaporii formați în cazan se condensează în tubul-spirală, iar apa rezultată este colectată într-un vas.
În industrie, în instalațiile pentru obținerea apei distilate, vaporii de apă sunt condensați în sisteme speciale de răcire cu funcționare continuă. Purificarea apei atât în laborator cât și în industrie se face însă de obicei cu ajutorul schimbătorilor de ioni.
Apă de mare puritate se obține prin electroosmoză. Pentru aceasta, apa, după o prealabilă purificare, este circulată încet printr-un vas cu pereții poroși, introdus într-o celulă electrolitică, între doi electrozi de grafit, în care circulă un curent de apă de spălare. Ionii, care constituie impuritățile apei, trec prin pereții poroși, atrași spre electrozii respectivi, și sunt antrenați de curentul de apă de spălare. Apa din vasul poros, eliberată de impurități are o conductibilitate specifică foarte mică (de ordinul 10-6).
Apa higroscopică
Multe substanțe ținute în aer rețin apa din atmosferă, fie sub formă de combinații chimice, fie adsorbită la suprafața lor. Apa adsorbită pe suprafață și în porii unei substanțe se numește apă higroscopică. Cantitatea de apă higroscopică reținută de o substanță nu depinde de cantitatea de substanță care o reține, ci de suprafața acesteia. De aceea, substanțele în pulbere, menținute la aer, se umezesc mai ușor decât cele în bucăți mari.
Apa higroscopică poate fi îndepărtată prin uscarea substanțelor la o temperatură de 105-110°C, în etuvă (în laborator) sau în cuptoare (în industrie).
Compoziția apei pure
Acum mai bine de două secole, Lavoisier a dovedit experimental că apa este o substanță compusă; trecând vapori de apă peste fier înroșit, el a obținut oxid de fier, Fe3O4, și hidrogen:
Compoziția apei poate fi stabilită pe cale de analiză sau pe cale de sinteză.
Molecula de apă fiind foarte stabilă, descompunerea apei în componentele ei poate fi realizată prin disociație termică la temperaturi înalte (peste 1000°C):
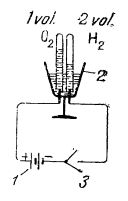
Descompunerea apei în componentele ei mai poate fi realizată și prin electroliză. În laborator se poate folosi în acest scop voltametrul:
Schema dispozitivului pentru electroliza apei în laborator:
1 - acumulator;
2 - voltametru;
3 - întrerupător.
În voltametru se introduce apă slab acidulată cu acid sulfuric (circa 10%), cu care se umplu și cele două eprubete puse peste electrozi. După închiderea circuitului electric, în eprubete se degajă gaze; când eprubeta de la polul negativ este complet umplută cu gaz (hidrogen), eprubeta de la polul pozitiv este umplută pe jumătate cu gaz (oxigen).
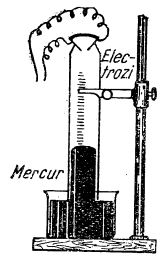
Pentru stabilirea compoziției apei pe cale de sinteză, în laborator se folosește eudiometrul:
Eudiometru cu mercur
În eudiometru se introduc două volume de hidrogen și un volum de oxigen; nivelul mercurului din tub coboară până la diviziunea respectivă a trei volume de gaz. Când se închide circuitul electric, în eudiometru se produce o scânteie: are loc o explozie și rezultă apă, iar mercurul se ridică în tub.
La temperatura camerei, apa formată este lichidă. Dacă tubul eudiometric este însă încălzit la temperatura de peste 100°C, apa rămâne în formă de vapori; aceștia ocupă două treimi din volumul ocupat de gaze, înainte de explozie.
Ținând seamă de raportul de combinare între hidrogen și oxigen (2:1, în volume, respectiv 1:8, în mase) rezultă compoziția masică a apei: 11,1% H2 și 88,9% O2.
Proprietăți fizice
Apa este un lichid incolor în cantități mici; privită în straturi groase are o culoare albăstruie-verzuie. Nu are miros și nici gust. Densitatea apei este maximă la 3,98°C, când este egală cu 1. La temperaturi mai mari sau mai mici de 3,98°C densitatea scade (conform tabelului de mai jos). Prin urmare, apa se comportă diferit față de celelalte lichide, a căror densitate scade continuu cu creșterea temperaturii. Acest lucru este extrem de important, atât din punct de vedere climatic, cât și biologic. În timpul iernii, apa de la suprafața râurilor, lacurilor, etc. se răcește și, având densitatea din ce în ce mai mare, se așază la fund, până când temperatura apei scade de la 3,98°C. La micșorarea temperaturii sub 3,98°C, apa, a cărei densitate începe să scadă, și apoi gheața, rămân la suprafață, unde formează un strat izolator față de frigul din afară. În acest fel, apele adânci nu îngheață până la fund, făcând astfel posibilă existența, în timpul iernii, a viețuitoarelor care trăiesc la fundul apelor.
| Caracteristica fizică | Valoare |
|---|---|
| Punct de topire, °C | 0,00 (273,16°K) |
| Punct de fierbere, °C | 100,00 |
| Densitatea, g/ml | |
|
la 0°C - solid
|
0,9168 |
|
la 0°C - lichid
|
0,999868 |
|
la 3,98°C
|
1,00 |
|
la 20°C
|
0,998230 |
| Căldura specifică la 15°C, cal/g | 1,00 |
| Căldura de topire, kcal/mol | 1,435 |
| Căldura de vaporizare, kcal/mol | 9,719 |
| Presiunea de vapori, mm Hg | |
|
la -5°C
|
3,01 |
|
la 0°C
|
4,58 |
|
la 20°C
|
17,53 |
|
la 50°C
|
92,51 |
|
la 100°C
|
760 (1 At) |
| Constanta dielectrică la 18°C | 80,1 |
| Conductivitatea, la 18°C, |
0,04•10-4 |
| Energia de disociere H2O → H++OH-, kcal/mol | 117,7 |
Căldura specifică a apei la 15°C este 1 cal/g. Ea este, în general, mai mare decât la alte substanțe. Din această cauză, temperatura cantităților mari de apă - cum e cazul lacurilor și al mărilor - se schimbă cu mult mai lent decât temperatura rocilor și a solului care alcătuiesc uscatul. Temperatura mai constantă a apei are, de aceea, un rol regulator asupra temperaturii aerului. Așa se explică de ce climatul la țărmul mării variază mai puțin în decursul anotimpurilor decât climatul pe continent.
Punctul de solidificare: apa se solidifică la 0°C. Spre deosebire de cele mai multe substanțe solide, gheața este mai ușoară decât apa în stare lichidă; în timpul solidificării, volumul apei se mărește cu 9%, astfel că gheața plutește pe apă. Mărirea volumului apei când îngheață poate cauza în timpul iernii spargerea vaselor, cazanelor, conductelor în care se găsește apa, fărâmarea unor stânci din munți prin ale căror crăpături a pătruns apa, etc.
Căldura latentă de solidificare a apei este de 79,4 cal/g H2O, adică 1.43 kcal/mol H2O.
După punctul de solidificare al apei, definit ca temperatura la care pot coexista gheața și apa, la presiune normală, a fost fixată temperatura 0°C.
Uneori, răcind apa sub 0°C, nu se formează gheața. Acest fenomen se numește subrăcire. Introducând un cristal de gheață în apa subrăcită are loc înghețarea ei bruscă și ridicarea temperaturii la 0°C.
Punctul de fierbere: la 100°C apa trece în stare de vapori mărindu-și volumul de circa 1700 ori. Căldura latentă de vaporizare a apei (respectiv căldura latentă de condensare a vaporilor de apă) este de 540 cal/g H2O, adică 9,72 kcal/mol H2O.
După punctul de fierbere al apei, adică temperatura la care pot coexista la echilibru apa și vaporii de apă, la presiune normală, a fost definită temperatura 100°C.
Uneori însă, încălzind apa, punctul de fierbere este depășit, fără ca fierberea să se producă; în acest caz are loc o supraîncălzire. Când apa supraîncălzită începe, însă, să fiarbă, atunci, din cauza cantității mari de vapori formați brusc, ea poate fi împroșcată din vasul în care se găsește. Așa se explică anumite explozii ale cazanelor de abur. Pentru a împiedica acest fenomen, în laboratoare se obișnuiește să se introducă în vasele de fierbere obiecte poroase sau cu muchii (cioburi de porțelan, piatră ponce, etc), datorită cărora se favorizează trecerea lichidului în stare de vapori.
Apa pură are conductibilitate electrică foarte mică datorită ionizării ei proprii extrem de reduse. Se știe că produsul ionic al apei este: [H3O]+•[OH]- → 1,1•10-14 ioni-g/l, la 20°C.
Deosebit de mare este însă constanta dielectrică a apei (
Sunt solubile în apă acele substanțe care au în molecule grupe ce pot forma cu apa legături de hidrogen sau compuși care formează ioni hidratați.
Cationii sunt cu atât mai puternic hidratați, cu cât sarcina lor este mai mare și dimensiunea mai mică. De exemplu, în soluții de concentrații egale, ionul Na+ poate lega opt molecule de apă, pe când ionul K+ poate lega patru molecule de apă. Tot așa, ionul Mg2+ poate lega 14 molecule de apă, pe când ionul Ca2+ poate lega zece molecule de apă. Anionii sunt de obicei mai puțin hidratați decât cationii. De exemplu, ionii de halogeni fixează 2-3 molecule de apă (prin legături de hidrogen).
Proprietatea de dizolvant a apei are mare importanță în tehnică, deoarece cele mai multe reacții chimice au loc în soluții apoase. Proprietatea de dizolvant a apei are un rol primordial și în natură; astfel, seva plantelor este o soluție apoasă de diferite săruri minerale extrase din sol; reacțiile biochimice sunt reacții în soluții apoase între diferitele substanțe din organismul animal, etc.
Structura moleculei de apă
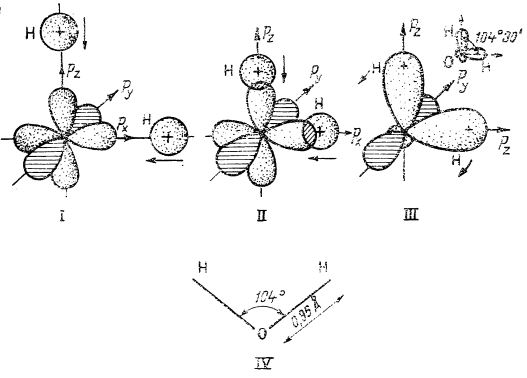
În atomul de oxigen toți cei trei orbitali p sunt ocupați: un orbital (de exemplu py) cu doi electroni, iar ceilalți doi orbitali (px și pz) cu câte un electron (fig. I, deasupra). Prin urmare, în acest atom cei doi electroni necuplați se cuplează cu câte un electron provenit de la cei doi atomi de hidrogen; întrepătrunderea se face în lungul axelor x - z (fig. II și III, deasupra). Deci, în molecula de apă formată, cele două legături O-H sunt dirijate în unghi drept.
Faptul că, în realitate, unghiul legăturilor O-H este mai mare de 90°, și anume de 104°30', se datorează în primul rând repulsiilor dintre atomii de hidrogen.
Pentru explicarea particularităților apei ca: densitatea maximă la 3,98°C, creșterea volumlui la trecerea apei în stare solidă, valoarea ridicată a căldurii latente de topire, etc. s-a admis că moleculele de apă sunt asociate și că trecerea din starea solidă în stare lichidă, de exemplu, este însoțită de o desfacere a moleculelor între ele, care necesită un plus de căldură față de căldura de topire propriu-zisă. Din motive analoge, și căldura latentă de vaporizare are o valoare atât de mare.
Cercetările efectuate au arătat că, la 100°C, vaporii de apă au o masă moleculară medie de 18,31, deci foarte apropiată de cea corespunzătoare formulei H2O (18,16), ceea ce dovedește că moleculele sunt asociate numai în foarte mică măsură. În stare lichidă, apa este însă formată din asociația unui număr mai mare de molecule prin legături de hidrogen.
Proprietățile chimice
Datorită caracterului exoterm pronunțat, molecula de apă este stabilă; abia pe la 2500°C, circa 10% din moleculele de apă sunt disociate termic.
Metalele acționează în mod diferit asupra apei, după poziția lor din seria tensiunilor electrochimice. Astfel, metalele alcaline, ca sodiul sau potasiul, reacționează cu apa chiar la temperatura obișnuită punând hidrogen în libertate. Reacția este atât de puternic exotermă, încât hidrogenul eliberat se aprinde. Calciul reacționează cu apa tot la temperatura obișnuită, însă reacția este lentă. Magneziul reacționează cu apa numai la 100°C. Fierul reacționează cu apa numai la temperaturi înalte.
Și unele nemetale reacționează cu apa. Astfel, dacă se trec vapori de apă peste cărbune înroșit rezultă oxid de carbon, CO, și hidrogen:
Apa reacționează și cu unii oxizi, și anume:
Hidrați
Atracția între moleculele substanței dizolvate și apa de hidratare este diferită după natura substanței. Uneori apa de hidratare se elimină chiar la evaporarea soluțiilor; alteori însă, apa este atât de puternic legată, încât intră în compoziția cristalelor substanței dizolvate, ca molecule întregi, formând apă de cristalizare. Sunt multe substanțe care cristalizează cu apă de cristalizare: carbonatul de sodiu, Na2CO3 • 10H2O, clorura de magneziu, MgCl2 • 6H2O, clorura de calciu, CaCl2 • 6H2O, sulfatul de fier, FeSO4 • 7H2O, sulfatul de aluminiu, Al2(SO4)3 • 18H2O, etc.
Hidrații au o compoziție chimică definită, care poate fi exprimată prin formulă, și au proprietăți fizice diferite de cele ale apei, precum și de ale substanțelor anhidre de la care derivă. Astfel, sulfatul de cupru anhidru, CuSO4, este o substanță albă, care cristalizează în prisme aciculare; pentahidratul CuSO4 • 5H2O cristalizează din soluție apoasă în cristale triclinice de culoare albastră.
Se consideră că în sulfatul de cupru pentahidrat, CuSO4 • 5H2O, patru molecule de apă sunt legate de ionul Cu2+ prin legături coordinative ("apă cationică"), iar a cincea moleculă este legată de ionul SO42- prin legături de hidrogen ("apă anionică").
Apa mai poate face parte din rețeaua cristalină a unor substanțe, ocupând poziții definite, fără să fie însă legată de anioni sau cationi ("apă de rețea"). De asemenea, ea poate intra în golurile rețelelor cristaline, fără însă să ocupe poziții definite în aceste rețele. Astfel de situații se întâlnesc de exemplu la rășini schimbătoare de ioni, unde pierderile de apă nu produc modificări ale structurii rețelelor cristaline.
Unele substanțe pot cristaliza cu cantități variabile de apă de cristalizare; de exemplu, chiar în cazul sulfatului de cupru, în afara pentahidratului menționat, mai există un trihidrat, CuSO4 • 3H2O, și un monohidrat, CuSO4 • H2O.
Prin încălzire, hidrații pierd treptat apa de cristalizare până când substanța rămâne anhidră:
CuSO4 • 5H2O → CuSO4 + 5H2O
Cu cât sunt mai puțin stabili, cu atât hidrații se descompun mai repede. De exemplu, carbonatul de sodiu cristalizat, Na2CO3•10H2O, numai expus la aer uscat pierde din apa de cristalizare și capătă aspectul unei pulberi. Asemenea substanțe se numesc eflorescente.
Există substanțe anhidre care, lăsate în aer umed, absorb vaporii de apă din atmosferă și trec în hidrați. De exemplu, clorura de magneziu, MgCl2, formează hidrați cu 2, 4, sau 6 molecule de apă. Astfel de substanțe se numesc higroscopice.
Când substanța higroscopică continuă să absoarbă apă, astfel încât în timp formează o soluție, aceasta se numește delicvescentă. O substanță foarte delicvescentă este clorura de calciu, CaCl2 • 6H2O.
Formarea de hidrați este un proces exoterm. Variația entalpiei sistemului la formarea unui mol de hidrat din compusul anhidru și apa lichidă se numește căldura de hidratare.
Preambul
Referințe
Edith Beral, Mihai Zapan: Chimie Anorganică, ediția a 3-a, Editura Tehnică, București, 1963