Bariul, Ba, este un metal alb-argintiu din grupa 2 (II A sau grupa a doua principală) a tabelului periodic. Are numărul atomic 56 și masa atomică 137,34. Bariul se găsește în natură în special în minereurile de baritină (sulfat de bariu, BaSO4) și de witerit (carbonat de bariu, BaCO3). Compușii solubili ai bariului sunt extrem de otrăvitori.
Bariul este răspândit în natură în special sub formă de baritină (sulfat de bariu, BaSO4) și de witerit (carbonat de bariu, BaCO3).
Se obține prin reducerea oxidului de bariu cu aluminiu sau siliciu, la 1200°C, în vid:
3BaO + 2Al = Al2O3 + Ba
3BaO + Si = BaSiO3 + 2Ba
Bariul este un metal alb, moale ca plumbul și foarte activ; se oxidează repede la aer și reacționează ușor cu apa, cu degajare de hidrogen. Se combină cu multe elemente. Bariul se întrebuințează ca adaos la aliajul de plumb pentru lagăre.
Oxidul de bariu, BaO, se obține prin calcinarea la 1400°C a carbonatului de bariu (în prezență de cărbune, pentru a reduce anhidrida carbonică formată și a deplasa astfel echilibrul) :
BaCO3 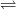 BaO + CO2
BaO + CO2
sau prin descompunerea azotatului de bariu:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
Este o pulbere albă, care se combină cu apa cu dezvoltare de căldură (
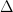
H = -17,3 kcal/mol) și formează hidroxidul de bariu. Încălzit în aer trece în peroxid de bariu:
BaO + ½ O2 = BaO2
Oxidul de bariu este folosit ca deshidratant pentru gaze, apoi în ceramică și la rafinarea zahărului.
Hidroxidul de bariu, Ba(OH)2, este o pulbere albă, solubilă în apă (la 20°C, solubilitatea este 38 g/100 g H2O); solubilitatea lui crește mult cu temperatura. Soluția are reacție puternică bazică. În laborator, soluția saturată de hidroxid de bariu, numită și apa de barită, este un reactiv curent, mai ales pentru dioxidul de carbon, cu care formează un precipitat alb de carbonat de bariu, BaCO3. Din soluția apoasă, hidroxidul de bariu cristalizează sub formă de hidrat, de exemplu Ba(OH)2·8H2O.
Peroxidul de bariu, BaO2, se obține prin trecerea unui curent de aer uscat, fără dioxid de carbon, la 500-600°C și 2 atm, peste oxid de bariu:
2BaO + O2 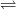 2BaO2;
2BaO2; 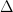 H = -16,2 kcal/mol
H = -16,2 kcal/mol
Reacția este reversibilă.
Peroxidul de bariu este o pulbere albă, insolubilă în apă și alcool. Poate fi oxidant și reducător; astfel, poate oxida sărurile feroase la săruri ferice, dar poate reduce unele săruri de metale grele până la metal:
HgCl2 + BaO2 = Hg + BaCl2 + O2
Fiind o sare a apei oxigenate, peroxidul de bariu este folosit pentru prepararea acesteia:
BaO2 + H2SO4 = BaSO4 + H2O2
Se mai utilizează la înălbirea textilelor, paielor, uleiurilor, grăsimilor, ca decolorant în industria sticlăriei și ca dezinfectant. Amestecat cu pulbere de magneziu este folosit ca amorsă pentru aprinderea termitului în aluminotermie.
Clorura de bariu, BaCl2, se obține prin tratarea carbonatului de bariu cu acid clorhidric:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
Industrial, se prepară prin reducerea sulfatului de bariu cu cărbune, urmată de reacția între sulfura de bariu și clorura de calciu:
BaSO4 + 4C = BaS + 4CO
BaS + CaCl2 = CaS + BaCl2
Este o masă albă, ușor solubilă în apă. Din soluție cristalizează ca dihidrat, BaCl2·2H2O, în tablete rombice. Este foarte otrăvitoare (o cantitate de 0,1 g la 1 kg din greutatea corpului omului, introdusă în stomac, este mortală).
Clorura de bariu se întrebuințează la prepararea altor săruri de bariu, în special a sulfatului de bariu, ca otravă pentru șobolani, etc.
Sulfatul de bariu, BaSO4, se găsește în natură ca mineralul baritină, uneori în cristale rombice, alteori sub formă de agregate fibroase, granulare sau pământoase. Este materia primă pentru aproape toate combinațiile bariului.
Sulfatul de bariu pur se obține prin tratarea clorurii de bariu cu acid sulfuric:
BaCl2 + H2SO4 = BaSO4 + 2HCl
Întrucât sulfatul de bariu precipită ori de câte ori sunt prezenți ioni Ba2+ și SO42-, reacția de formare a BaSO4 folosește la identificarea acestor ioni.
Sulfatul de bariu este o substanță cristalină, de culoare albă, insolubilă în apă (la 18°C, se dizolvă 0,22 mg BaSO4 în 100 g apă).
Sulfatul de bariu este opac pentru razele X; de aceea se întrebuințează în medicină (la radioscopie). Nefiind solubil, nu este toxic.
Din cauza stabilității lui față de aer și temperatură, sulfatul de bariu este folosit ca pigment alb în vopsitorie, ca material de umplutură pentru cauciuc și linoleum, la fabricarea unor calități de hârtie etc. Având densitate mare, este întrebuințat la îngreunarea noroaielor de foraj la sonde petroliere.
Azotatul de bariu, Ba(NO3)2, se prepară prin tratarea carbonatului de bariu cu acid azotic:
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2 + H2O
sau prin reacția de dublu schimb între clorură de bariu și azotat de sodiu:
BaCl2 + 2NaNO3 = Ba(NO3)2 + 2NaCl
Este o substanță cristalină puțin solubilă în apă și insolubilă în alcool. Prin încălzire pierde oxigen trecând în azotit și apoi în oxid de bariu. Este folosită în pirotehnie deoarece colorează flacăra în verde.
Carbonatul de bariu, BaCO3, se găsește în natură ca mineralul witerit, cristalizat în sistemul rombic, izomorf cu aragonitul și stronționitul.
În industrie se prepară prin reducerea sulfatului de bariu cu cărbune, la 600-800°C, și tratarea soluției apoase de sulfură de bariu cu dioxid de carbon:
BaSO4 + 2C = BaS + 2CO2
BaS + CO2 + H2O = BaCO3 + H2S
În apă este puțin solubil, soluția apoasă având reacție bazică datorită hidrolizei.
Carbonatul de bariu se descompune la temperatură cu mult mai ridicată decât carbonații de calciu și de stronțiu (peste 1400°C). Este întrebuințat la fabricarea sticlelor greu fuzibile și a emailurilor pentru ceramică.
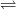 BaO + CO2
BaO + CO2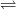 2BaO2;
2BaO2; 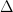 H = -16,2 kcal/mol
H = -16,2 kcal/mol





