Bromul, Br
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Bromul, Br, este al treilea element din grupa 17 (VII A), grupa halogenilor; are numărul atomic 35 și masa atomică 79,909. Bromul este un lichid roșu-brun volatil la temperatura camerei; vaporii degajați sunt tot de culoare maroniu-roșiatică, au un miros puternic, neplăcut și sufocant. Lichidul atacă țesuturile, iar vaporii irită ochii și gâtul. Bromul este singurul nemetal lichid la temperatura camerei. Denumirea vine de la grecescul bromos care înseamnă "duhoare, miros greu".
Răspândire în natură
Ca și clorul, bromul nu se găsește în stare liberă în natură; se găsește însă sub formă de bromuri (de sodiu, de potasiu și de magneziu) în apa mărilor și oceanelor, alături de cloruri, dar în concentrație mică (0,001% - 0,007%); cantități mari de bromură de magneziu se găsesc în Marea Moartă (4,8%).
Bromurile însoțesc clorurile și în zăcăminte, aproximativ în aceeași proporție ca și apa mărilor (1 : 3000). De exemplu, la minele de sare de lângă Strassfurth, Germania, sunt zăcăminte de carnalit care conțin și brom (brom-carnalit, MgBr2・KBr・6H2O).
Mici cantități de brom se găsesc în apele sondelor petroliere. Unele plante și animale marine conțin brom în organism.
Preparare
În laborator, bromul se prepară tratând o bromură cu acid sulfuric în prezența unui oxidant, de obicei bioxid de mangan:
2KBr + 3H2SO4 + MnO2 → 2KHSO4 + MnSO4 + 2H2O + Br2
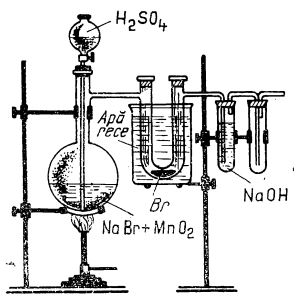
Pentru aceasta, într-un balon de sticlă (după cum e ilustrat în figura de mai jos), se introduce bromură de potasiu (sau de sodiu) și bioxid de mangan, iar prin pâlnie se toarnă acid sulfuric (2 : 1). Balonul se încălzește; vaporii de brom rezultați trec într-un tub în formă de U, răcit cu apă și gheață, în care se condensează. Vaporii necondensați sunt opriți de soluția de hidroxid de sodiu într-o eprubetă legată cu tubul în formă de U.
Prepararea bromului în laborator
În principiu, reacția constă în oxidarea acidului bromhidric la brom:
2HBr + O → H2O + Br2
Prepararea industrială a bromului se bazează pe proprietatea pe care o are clorul de a înlocui bromul din compușii săi. În acest scop, în apele rămase de la extracția sărurilor minereurilor care conțin bromuri (ape mame) se introduce un curent de clor:
MgBr2 + Cl2 → MgCl2 + Br2
Operațiunea se face în coloane în care circulă clorul gazos în contracurent cu apele ce conțin brom. Bromul gazos obținut este apoi condensat în răcitoare.
În unele țări, bromul se extrage din apa mării, prin tratarea cu clor, în vederea înlocuirii bromului din bromura de magneziu. Bromul (ca și iodul) se mai poate extrage și din apele sondelor petroliere supuse, de asemenea, acțiunii clorului.
Proprietăți
Bromul este singurul nemetal lichid în condiții obișnuite. Are culoarea roșie-brună. Din cauza punctului de fierbere foarte scăzut (58,8°C), la temperatura normală bromul emite vapori de culoare brună-roșiatică. Prin solidificare (la -7,3°C) trece într-o masă cristalină cu un slab luciu metalic.
Bromul se dizolvă puțin în apă (3,55 g în 100 g apă, al 20°C) formând apa de brom, care este un oxidant mai slab decât apa de clor:
Br2 + H2O → HBr + HBrO
HBrO → HBr + O; 2O → O2
Mai bine se dizolvă în dizolvanți organici (sulfură de carbon, benzen, cloroform, tetraclorură de carbon, etc). De aceea poate fi extras dintr-o soluție diluată, folosind dizolvanți organici.
Bromul fiind mai puțin reactiv decât clorul poate fi înlocuit de clor din combinațiile sale cu hidrogenul și cu metalele:
2Br- + Cl2 → 2Cl- + Br2
Astfel, dacă la o soluție de bromură de potasiu se adaugă apă de clor și se agită, soluția incoloră se colorează în galben-brun din cauza dizolvării în apă a bromului pus în libertate de către clor. Dacă în continuare se adaugă cloroform și se agită, după repaus se observă separarea a două straturi: un strat inferior de cloroform, colorat în brun de către bromul extras din soluția apoasă, și deasupra un strat de lichid incolor - soluția de clorură de potasiu. Reacția servește la identificarea bromului.
Bromul reacționează cu hidrogenul la încălzire, în prezență de catalizatori, formând acidul bromhidric, HBr. El se poate combina direct și cu nemetalele (excepție fac oxigenul, azotul și carbonul), de cele mai multe ori foarte energic. De asemenea se combină direct cu metalele formând bromuri. Platina nu este atacată de brom.
Bromul distruge substanțele organice; de aceea, sticlele care conțin brom nu se închid cu dopuri de cauciuc sau de plută.
Bromul are un miros iritant și o acțiune dăunătoare asupra mucoaselor organelor respiratorii; chiar în concentrație foarte mică atacă pielea provocând răni dureroase.
Utilizare
Bromul folosește la prepararea unor compuși organici: coloranți, gaze lacrimogene (de exemplu, bromacetona), etc. Fiind agent oxidant, are întrebuințări ca antiseptic și dezinfectant.
Referințe
2. John Daintith: Dictionary of Chemistry, 6th edition, Oxford University Press, 2008, ISBN 9780199204632