Calciul, Ca, este un metal alcalino-pământos alb strălucitor, și moale precum metalele alcaline; se găsește în grupa 2 a tabelului periodic (II A sau grupa a doua principală). Calciul are numărul atomic 20 și masa atomică 40,08. Combinațiile calciului sunt foarte comune în scoarța terestră; exemple de compuși ai calciului întâlniți frecvent în natură sunt: calcarul și marmura (carbonați de calciu, CaCO3), ghips (sulfat de calciu, CaSO4·2H2O), fluorina (fluorură de calciu, CaF2). Calciul este un element esențial pentru organismele vii fiind necesar în procesele de creștere și dezvoltare.
Răspândire în natură
Calciul este răspândit în natură numai sub formă de combinații, alcătuind 3,4% din scoarța pământului. Sub formă de
piatră de var (carbonat de calciu, CaCO
3) a fost cunoscut și întrebuințat ca material de construcție încă din vechime, ca și
marmura, alt carbonat de calciu. Tot un carbonat de calciu este și
creta.
Dolomitul, CaCO
3·MgCO
3, este de asemenea extrem de răspândit în natură. Zăcăminte importante formează sulfații de calciu:
ghipsul, CaSO
4·2H
2O, și
anhidritul, CaSO
4. Minerale de calciu sunt și
fosforitul, 3Ca
3(PO
4)
2·Ca(OH)
2,
fluorapatitul, Ca
5[F(PO
4)
3]
2,
fluorina (fluorura de calciu), CaF
2 etc. Apele dure conțin mari cantități de săruri de calciu.
Și în lumea organică calciul are un rol important; calciul este un element esențial pentru organismele vii fiind necesar pentru creștere și dezvoltare. În animale este un constituent de bază pentru oase și dinți, coaja ouălor, cochiliilor scoicilor, etc. Calciul este prezent și în sânge fiind necesar pentru contracțiile musculare și alte procese metabolice. În plante este un constituent al lamelei mijlocii sub formă de pectină de calciu (lamela mijlocie este un material intercelular care ține împreună celulele adiacente).
Obținere
Calciul se obține prin electroliza clorurii de calciu topite, căreia i se adaugă fluorină sau clorură de potasiu drept fondant. Electroliza se execută cu electrozi de oțel. Temperatura trebuie menținută constantă în jurul punctului de topire al topiturii. Calciul lichid se depune pe catodul de oțel, care încet și continuu se ridică din topitură așa încât metalul depus se solidifică imediat sub formă de bară.
Calciul de puritate înaltă se prepară prin încălzirea clorurii de calciu cu aluminiu metalic; se formează clorura de aluminiu care se volatilizează, iar calciul se supune unei distilări sub vid înaintat.
Proprietăți
Calciul este un metal alb strălucitor moale ca și metalele alcaline. Cristalizează în sistemul cubic (formând rețele cubice compacte).
În aer, calciul se oxidează mai ușor decât magneziul, dar cu mai multă greutate decât metalele alcaline; totuși trebuie păstrat sub petrol. Arde cu flacără cărămizie trecând în oxid de calciu, CaO.
Le temperatură mai ridicată (450°C) se combină energic cu azotul formând nitrura de calciu, Ca3N2. Din această cauză, calciul este folosit pentru îndepărtarea azotului (și oxigenului) din aer în vederea obținerii gazelor rare.
Calciul topit se combină energic cu hidrogenul și formează hidrura de calciu, CaH2. Se poate combina atât cu halogenii cât și cu sulful. Reacționează cu apa cu formare de hidroxid de calciu și dezvoltare de hidrogen:
Ca + 2H2O = Ca(OH)2 + H2
La temperatura obișnuită, reacția este lentă.
Cu acizii diluați, calciul reacționează energic:
Ca + 2H+ = Ca2+ + H2
Calciul se dizolvă în amoniac lichid; după evaporarea amoniacului rămâne o masă colorată în galben-auriu, având compoziția unei hexamine de calciu, [Ca(NH3)6]2+.
Calciul ca metal are întrebuințări limitate. În cantități mici se adaugă aliajelor pentru lagăre.
Combinațiile calciului, ca și cele ale magneziului, se obțin fie din carbonați sau sulfați naturali, fie ca produse secundare în diferite sectoare industriale.
Oxidul de calciu, CaO, se obține în industrie prin calcinarea carbonatului de calciu în cuptoare, de unde și numele lui de
var ars (sau
var nestins):
CaCO3 = CaO + CO2; 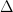 H = 34,6 kcal/mol
H = 34,6 kcal/mol
Arderea se face la temperaturi peste 800°C. Pe măsura arderii trebuie îndepărtat dioxidul de carbon, a cărui tensiune de vapori peste 850°C este mai mare decât presiunea atmosferică.
Cuptoarele pentru arderea pietrei de var sunt de diferite tipuri. Cele simple sunt construite în formă ovală, din cărămizi obișnuite; fabricația nu este continuă. Cuptoarele de tipul acesta se găsesc mai ales în regiunea de munte, unde lemnul este la îndemână pentru a fi utilizat drept combustibil.
La cuptoarele mai perfecționate, piatra de var se introduce prin deschiderea superioară a cuptorului, în timp ce prin partea de jos se scoate, pe măsura arderii, varul ars:
Cuptor industrial pentru obținerea varului
Cuptorul funcționează continuu, astfel încât prezintă avantajul unei economii de timp și combustibil. Asemenea cuptoare sunt încălzite cu cărbuni, păcură sau cu gaz metan. Prin arderea pietrei de var, pe lângă oxidul de calciu se obține și o cantitate însemnată de dioxid de carbon care, în cuptoarele moderne, este colectat și folosit în diferite procese chimice, de exemplu la fabricarea carbonatului de sodiu după procedeul cu amoniac.
Oxidul de calciu este o substanță albă, cu punct de topire ridicat. Cu apa reacționează energic cu formare de hidroxid de calciu. Reacția este însoțită de o puternică dezvoltare de căldură:
CaO + H2O = Ca(OH)2; 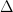 H = -15,2 kcal/mol
H = -15,2 kcal/mol
Încălzit cu cărbune la temperatura de 2000°C, oxidul de calciu se transformă în carbură de calciu (carbid):
CaO + 3C 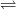 CaC2 + CO
CaC2 + CO
Oxidul de calciu, ca orice oxid bazic, reacționează cu anhidride acide și acizi. De exemplu, cu dioxidul de carbon formează carbonat de calciu:
CaO + CO2 = CaCO3
Oxidul de calciu are diferite întrebuințări: pentru uscarea gazelor (fiind foarte avid de apă), la purificarea gazului de iluminat (deoarece absoarbe dioxidul de carbon și alte impurități din gaz), apoi în metalurgie (drept căptușeală de cuptoare, dar și ca adaos la minereuri, în timpul topirii, în vederea extragerii metalelor), în industria sticlei, în industria îngrășămintelor și, în special, la prepararea hidroxidului de calciu.
Hidroxidul de calciu, Ca(OH)
2, se obține prin combinarea oxidului de calciu cu apă. Trecerea oxidului de calciu în hidroxid de calciu, sub acțiunea apei, este cunoscută sub numele de
stingerea varului, iar hidroxidul de calciu rezultat astfel se numește
var stins.
Dacă se tratează mai departe hidroxidul de calciu cu apă se obține laptele de var. Acesta este format din hidroxid de calciu, parte în soluție și parte în suspensie în apă, solubilitatea hidroxidului de calciu în apă fiind foarte mică (solubilitatea la 20°C este 0,129 g Ca(OH)2/1000 g H2O).
Lăsat mai mult timp în repaus, hidroxidul de calciu care era în suspensie (nedizolvat) se depune la fundul vasului și deasupra rămâne o soluție limpede de hidroxid de calciu, apa de var. Aceasta are caracter puternic bazic.
Hidroxidul de calciu se combină cu zaharoza și formează zaharați; aceștia pot conține 1-6 molecule de CaO la o moleculă de zaharoză.
O reacție caracteristică a hidroxidului de calciu este reacția cu dioxidul de carbon, când rezultă carbonatul de calciu:
Ca(OH)2 + CO2 = CaCO3 + H2O
De aceea, varul stins, lăsat în aer liber, absorbind încet dioxidul de carbon, trece în carbonat de calciu solid, adică se carbonatează.
Deoarece carbonatarea varului se produce cu contracție de volum, carbonatul de calciu rezultat este sfărâmicios. De aceea, la folosirea varului în construcții i se adaugă o anumită cantitate de nisip. Granulele de nisip formează împreună cu varul stins o pastă uniformă, aderentă de cărămidă, care adsoarbe o parte din apa de amestec; pe de altă parte, prin carbonatarea varului, amestecul se întărește. Amestecul care se obține astfel poartă numele de mortar sau tencuială. Acest amestec servește ca material de legătură între cărămizi, precum și pentru protecția zidurilor contra intemperiilor.
Cantități mari de hidroxid de calciu se folosesc în industria zahărului, apoi la obținerea clorurii de var, a clorurii de calciu, la prepararea sodei caustice prin caustificare. Ca lapte de var este folosit în industria tăbăcăriei (având proprietăți caustice, îndepărtează părul de pe pieile crude, adică este un depilator) și pentru distrugerea substanțelor organice intrate în putrefacție (laptele de var fiind și dezinfectant); în amestec cu sulfat de cupru, laptele de var este utilizat pentru stropitul viilor. Apa de var era folosită în medicină pentru comprese la arsuri și ca antidot la unele intoxicații cu acid sulfuric.
Dintre sărurile de calciu, mai importante sunt: fluorura, clorura, carbonatul, sulfatul și fosfatul.
Fluorura de calciu, CaF
2, se găsește în natură sub forma de
fluorină. Se prepară prin neutralizarea carbonatului de calciu cu acid fluorhidric diluat. Este greu solubilă în apă, cu care formează soluții coloidale. Cu acidul fluorhidric formează o sare acidă, CaF
2·2HF·6H
2O, care este ușor solubilă.
Prin încălzire cu acid sulfuric dezvoltă acid fluorhidric:
CaF2 + H2SO4 = CaSO4 + 2HF
Fluorura de calciu este întrebuințată la gravarea sticlei și ca opacizant în industria glazurilor ceramice.
Fiind foarte rezistentă față de substanțe reducătoare, mai ales față de metale, este folosită la confecționarea creuzetelor și formelor necesare fabricării uraniului metalic destinat reactoarelor nucleare.
Clorura de calciu, CaCl
2, se obține prin trecerea unui curent de clor peste Ca(OH)
2, urmată de calcinarea produsului, sau ca produs secundar la fabricarea sodei caustice după procedeul cu amoniac. Foarte pură se obține prin tratarea carbonatului de calciu cu acid clorhidric.
Clorura de calciu anhidră este o masă albă, foarte higroscopică, care se topește la 780°C. Se dizolvă în apă, cu puternică degajare de căldură datorită hidratării (
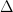
H = -17,4 kcal/mol).
Clorura de calciu formează mai mulți hidrați, dintre care cel mai stabil este hexahidratul, CaCl2·6H2O, cristale prismatice a căror dizolvare în apă este însoțită de o puternică scădere de temperatură. Este folosită la amestecuri răcitoare (prin amestecarea clorurii de calciu cu zăpadă, în raport de 1,44:1, se poate forma un eutectic cu temperatură de -54,9°C).
În stare topită este folosită pentru obținerea electrolitică a calciului metalic. Ea se mai utilizează ca adaos la ciment pentru ca acesta să poată face priză și la temperaturi scăzute, apoi pentru prepararea soluțiilor transportoare de frig în aparate de răcire sub 0°C și în radiatoare de motoare în timpul iernii. De asemenea este folosită pentru impregnarea lemnului ca ignifug și în industria textilă (în amestec cu amidon) pentru apret; sub formă de pulbere sau soluție se împrăștie pe drumurile cu mult praf pentru a menține umiditatea.
Fiind foarte higroscopică, clorura de calciu anhidră este folosită pentru deshidratarea gazelor și lichidelor. În stare pură este folosită în medicină.
Azotatul de calciu, Ca(NO
3)
2, rezultă prin putrezirea gunoiului de grajd în prezența varului. Se prepară prin neutralizarea carbonatului sau hidroxidului de calciu cu acid azotic. Cristalizează în stare anhidră în octaedre regulate; din soluții apoase se separă sub formă hidratată, Ca(NO
3)2·4H
2O, în prisme monoclinice, care se topesc peste 40°C în apa lor de cristalizare. În stare anhidră, azotatul de calciu este foarte higroscopic și foarte solubil în apă și alcool. Prin calcinare trece în oxid de calciu, cu degajare de oxizi de azot. Azotatul de calciu poate fi folosit drept îngrășământ agricol, cu adaos de var.
Carbonatul de calciu, CaCO
3, este unul dintre compușii cei mai răspândiți în natură, sub formă de
calcit,
marmură,
aragonit, precum și sub formă de
piatră de var,
cretă etc.
Calcitul apare în natură cristalizat în sistemul hexagonal, în romboedre, care uneori au mărimi apreciabile. La cristalele transparente și mari se observă fenomenul de birefringență, mai ales la calcitul din Islanda (“spatul de Islanda”). La 970°C, calcitul trece în altă modificație cristalină, tot din sistemul hexagonal.
Marmura este o varietate cristalină de carbonat de calciu care se extrage din cariere, de unde se taie în blocuri. Marmura poate fi albă, cu cristale mărunte, care se aseamănă cu zahărul - de unde și numele de marmură zaharoidă - sau colorată în roz, galben, verde, negru, din cauza diferitelor impurități care s-au infiltrat în masa de carbonat de calciu.
Piatra de var, foarte răspândită în scoarța pământului, este formată din cristale mici de calcit. De obicei este amestecată cu alte minerale, de exemplu cu carbonat de magneziu (dolomit). Când este amestecată cu argilă se numește marnă.
Creta este un carbonat de calciu de culoare albă, cu granulație fină și foarte sfărâmicios. Ea este alcătuită din resturi de animale microscopice.
Mai sunt și alte varietăți de carbonat de calciu, formate din depunerea scoicilor și a cochiliilor unor animale inferioare, cimentate într-un ciment calcaros.
Carbonatul de calciu este componentul principal al oaselor animalelor; coaja ouălor păsărilor este alcătuită din carbonat de calciu. Carbonatul de calciu este o substanță albă, foarte greu solubilă în apă (100 g apă dizolvă 1,3 mg CaCO3, la 20°C). Din această cauză, dacă într-o soluție sunt prezenți ioni Ca2+ și CO32-, se formează un precipitat alb, cristalin, de carbonat de calciu:
Ca2+ + CO32- 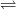 CaCO3
CaCO3
Dacă se adaugă însă dioxid de carbon, precipitatul dispare, deoarece se formează carbonat acid de calciu, care este solubil:
CaCO3 + CO2 + H2O 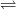 Ca(HCO3)2
Ca(HCO3)2
Reacția este reversibilă; de aceea, apele care conțin dizolvate cantități mari de carbonat acid de calciu (ape dure) nu se folosesc la alimentarea cazanelor cu abur, locomotive, turbine etc., deoarece din cauza încălzirii, carbonatul acid se descompune, dioxidul de carbon se degajă, iar carbonatul neutru se depune, formând piatră de cazan împreună cu alte săruri din apă.
Prin calcinare, carbonatul de calciu se disociază în CaO + CO2. Reacția are o importantă aplicare practică, fiind reacția de obținere a varului și a dioxidului de carbon din piatra de var.
Întrebuințările carbonatului de calciu sunt foarte diferite. Astfel se folosește în industria chimică la prepararea altor săruri de calciu, în industria zahărului pentru limpezirea zemei de sfeclă, a vinului, în industria hârtiei și cauciucului drept material de umplutură, în cosmetică drept component al multor pudre și alifii etc. În stare foarte pură se folosește în medicină. Dintre toate întrebuințările lui, cele mai importante rămân însă fabricarea varului și cimentului pentru construcții.
Marmura, fiind un material rezistent la uzură și intemperii, este folosită la construcții de clădiri importante, monumente și pavaje; piatra de var este întrebuințată drept piatră de construcții; creta este folosită pentru scris pe tablă.
Sulfatul de calciu se găsește foarte răspândit în natură, anhidru, CaSO
4 ca mineralul
anhidrit, sau hidratat, CaSO
4·2H
2O, ca mineralul ghips. Deseori se mai găsește dizolvat în apă, imprimându-i
duritatea permanentă (solubilitatea sulfatului de calciu în apă este însă foarte mică: circa 200 mg în 100 g apă, la 20°C).
Ghipsul cristalizează în sistemul monoclinic, în cristale incolore, transparente, care pot cliva. Uneori, cristalele de ghips sunt prinse două câte două, formând macle:
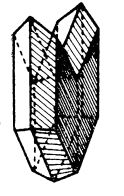 Maclă de ghips
Maclă de ghips
Ghipsul cristalizat și translucid se numește alabastru și se aseamănă cu marmura; el are valoare ca piatră de ornamentație în construcție sau pentru confecționarea de obiecte de artă, putându-se lustrui și lucra foarte bine. În stare pură, cristalină, este alb, dar poate fi colorat din cauza impurităților. Spre deosebire de marmură are conductibilitate termică redusă; de aceea, la atingere nu este rece ca marmura.
Ghipsul se exploatează în mari cantități pentru a fi transformat în ipsos, 2CaSO4·H2O (prin încălzire în cuptoare la temperatura de 180°C). Ipsosul amestecat cu apa formează un terci care se solidifică repede devenind o masă alcătuită din cristale mici de ghips:
2CaSO4·H2O + 3H2O = 2CaSO4·4H2O
Pe această proprietate se bazează întrebuințarea ipsosului în sculptură și construcții.
Dacă încălzirea ghipsului are loc însă peste 200°C, atunci deshidratarea este completă și materialul obținut nu mai poate face priză.
Sulfatul de calciu se descompune la temperaturi peste 1000°C în oxid de calciu, oxigen și dioxid de sulf:
2CaSO4 → 2CaO + 2SO2 + O2
Temperatura de descompunere poate fi scăzută prin adaos de SiO2, Al2O3, Fe2O3, argile, caolin, cărbuni etc. Dacă se încălzește un amestec de ghips cu argilă și cărbune la circa 1000°C, se degajă dioxid de sulf (materie primă pentru prepararea acidului sulfuric) și rămâne un clincher (din care se prepară cimentul portland).
Ipsosul fin pulverizat are numeroase întrebuințări în construcții, pentru mulaje (mai ales în ceramică, din cauza porozității lui), ca îngrășăminte pentru terenurile sărace în calcar, pentru prepararea unor pigmenți albi, în industria sticlei și a cimentului, la prepararea stucului (întrebuințat pentru ornamentațiile interioare ale clădirilor) etc.
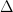 H = 34,6 kcal/mol
H = 34,6 kcal/mol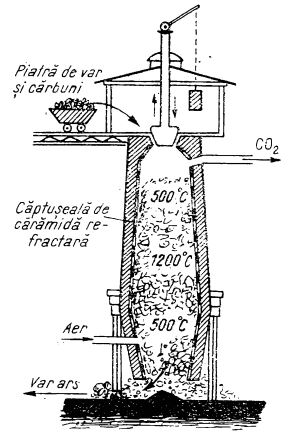
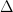 H = -15,2 kcal/mol
H = -15,2 kcal/mol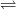 CaC2 + CO
CaC2 + CO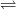 CaCO3
CaCO3 Ca(HCO3)2
Ca(HCO3)2






