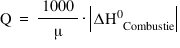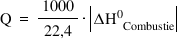Căldura de combustie
Tag-uri
Partajeaza in Google Classroom

Transcript
în viața noastră de zi cu zi întâlnim
foarte des anumită procese fizice
și chimice precum arderea dizolvarea
și neutralizarea și le întâlnim
și mai des atunci când lucru laborator
astfel este extrem de important
să cunoaștem efectele termice ale
acestora atât pentru a ne proteja
cât și pentru a folosi energia
termică în scopuri practice procesele
de ardere stau mai formal de combustie
reprezintă de la descoperirea focului
încoace principala sursă de energie
termică necesară pentru activitățile
omului de la încălzit Ciorba și
până la cele mai complexe a procese
industriale na putea face nimic
fără combusta Mai degrabă fără
combustibil combustibilii sunt
materialele care constituie sursa
de energie termică atât pentru
viața cotidiană cât și pentru diferitele
procese industriale și drag combustibil
avem motorină păcură gazele naturale
și gazele de sondă butanul cărbunii
Lemnul și alte resturi vegetale
combustia se desfășoară în condiții
izobare adică la presiune constantă
dar cu volum variabil am vorbit
lecția trecută despre Antal piston
Da am vorbit lecția trecută despre
entalpii de reacție scandal entalpii
de reacție Standard au denumit
speciale și o semnificație aparte
având în vedere că procesul de
compus este desfășoară la presiune
constantă în tălpi ia de combustie
Standard este una dintre aceste
entalpii cu semnificația și se
notează cu Delta H indice combustie
sau ce mai pe entalpia de combustie
Standard reprezintă entalpia de
reactie stender pentru oxidarea
completă a unui compus organic
la Adi oxid de carbon de jos și
la apă sub formă lichidă asta în
cazul în care compusul conține
numai carbon hidrogen și oxigen
și la azot gazos în cazul în care
compusul conține și azi o combustia
e un caz special la unui termen
mai general Și anume oxidarea inițial
oxidare a se referea la reacții
cu oxigen care nu sunt neapărat
însoțite de flacără pentru a efectua
ori alte de combustie avem nevoie
de un combustibil să zicem Metalul
sau o hidrocarbură mai grea plecam
octanul pe care îl folosim în motoarele
cu combustie internă amestecăm
cu aer și îi dăm foc după cum am
zis rezultatul are 3 complete aur
care intră cu arbori este dioxid
de carbon gazos și apă sub formă
lichidă însă poate avea loc și
ardere incompletă și atunci Rezultatul
este monoxid de carbon și diverse
fragmente din hidrocarbura inițial
toate reacțiile de combustie sunt
reacții exoterme și eliberează
foarte multe energie sub formă
de căldură în mediul exterior această
căldură căldură de combustie iar
căldura de combustie reprezintă
variația de entalpie dintru în
proces de combustie avem Spre exemplu
combustia glucozei această valoare
a variației entalpiei de combustie
ne arată că 2808 kg de căldură
se eliberează atunci când un mol
de Glucoză este oxidat complet
în condiții standard de presiune
și temperatură în arderile biologice
apa se obține sub formă lichidă
în arderile din locuințele noastre
și cele industriale apa se obține
sub formă de vapori ploua avem
aici două reacții de ardere a metanului
în condiții stat dar prima se obține
o căldură de combustie de 800 2
kg vedem că apa rezultată din reacție
este sub formă de vapori iar în
a doua reacție Când apar rezultatele
Ricky de căldură de combustie de
890 kj de ce mai mare diferența
dintre cele două călduri de combustie
este chiar căldura absorbită în
procesul de vaporizare a apei închide
pentru 2 moli de apă înmulțim această
valoare cu 2 si vedem că este chiar
diferența dintre entalpiile celor
două ore pentru a aprecia calitatea
unui combustibil ne folosim de
o proprietate numită putere calorică
puterea calorică a unui combustibil
se exprimă prin cantitate de căldură
degajată la arderea unității de
masă sau de volume A combustibilului
puterea calorică a combustibililor
gazoși exprimată în general în
chiloți jul pe metru cu volumul
de 1 metru cub a măsurat în condiții
normale de temperatură și presiune
atenție condițiile normale se referă
la o temperatură de 0 grade Celsius
sau 273 Kelvin și presiune de o
atmosferă deci nu e același lucru
în condițiile Standard avem la
piață cu normal metru cu în ceea
ce privește combustibili lichizi
sau solid puterea doar ca Lori
că este exprimată în chiloți pe
kilogram pentru că de obicei puterea
calorică are valori foarte mari
o putem exprimă și în Mega Juli
pe metru cub sau Mega Juli pe kilogram
și ținem cont de faptul că un mega
Juli este egal cu 10 la a treia
kilojouli Care este egal cu 10
la 6 ajuy după cum am văzut mai
înainte cantitatea de căldura degajată
la arderea combustibililor depinde
de starea de agregare a apei c
rezultă din reacția de ardere a
astfel Avem două tipuri de puteri
calorice putere calorică superioară
notată cu chiuind e chestie când
vin ardere rezultă apă în stare
lichidă și putere calorică inferioară
quindi c e când din reacția de
ardere rezultă apă în stare de
vapori și avem observație practică
foarte importante legate de conținutul
lui drojin al unui combustibil
cu cât un combustibil conține mai
multe introduce cu atât rezultă
o cantitate mai mare de apă din
reacția de ardere iar diferența
dintre puterea calorică superioară
și cea inferioară va fi mai mare
să luăm niște exemple pentru monoxidul
de carbon valoarea puterii calorice
superioare este egală cu valoarea
puterii calorice inferioare asta
pentru că după cum observăm monoxidul
de carbon nu conține deloc hidrogen
și exemplu metanului compus care
conține hidrogen în acest caz observăm
deja o diferență considerabilă
între valorile celor două puteri
calorice ce se întâmplă în cazul
arderii unui compus cu și mai mult
și dulce avem Spre exemplu propanul
în acest caz observăm că avem o
diferență și mai mare între puterea
calorică superioară și cea inferioară
ce Dacă tot am vorbit despre valorile
puterilor calorice Haideți să vedem
Și cum anume putem calcul acestei
valori între puterea calorică q
a unui combustibil și variația
de entalpie în reacția de ardere
în condiții Standard adică în stația
de combustie putem stabili una
dintre aceste relații în funcție
de starea de agregare a combustibilului
entalpia de combustie se află în
modul acesta convenit ca puterea
calorică să aibă numai valori pozitive
în cazul lichidelor și solidelor
avem în ecuație mio care reprezintă
masa molară în grame pe Mol iar
în cadrul Nora din volumul pe care
îl ocupă un mol de gaz ideal în
condiții Standard Deci 22 l pe mall
pentru combustibili stare lichidă
sau solidă această ecuație pentru
puterea calorică reprezintă căldura
degajată la arderea unui kilogram
de combustibil de silozul pe kilogram
ca unitate de măsură iar pentru
combustibili stare de gaz puterea
calorică a reprezintă cantitatea
de căldură degajată la arderea
unui normal metru cub de combustibil
Așadar avem aici silozul pe normal
metru cub de tu unitate de măsură