Clorul, Cl
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Reacția cu nemetale
Reacția cu apa
Reacția cu compuși anorganici
Reacția cu substanțe organice
Clorul este un element chimic cu simbolul Cl, numărul atomic 17 și masa atomică 35,453; este al doilea element din grupa 17, grupa halogenilor. Clorul este un gaz otrăvitor, galben-verzui, care se găsește din abundență în natură sub formă de clorură de de sodiu în apa de mare, și în minereuri. A fost descoperit în 1774 de Karl Scheele și confirmat drept element chimic în 1810.
Răspândire în natură
Clorul este relativ mult răspândit în natură (în compoziția litosferei și hidrosferei intră în proporție de 0,19%). Liber se găsește numai ca urme, în gazele emanate de vulcani. Sub formă combinată este însă foarte răspândit, mai ales sub formă de sare de bucătărie (clorură de sodiu, NaCl), silvină (clorură de potasiu, KCl), sau carnalit (clorură dublă de potasiu și magneziu, KCl • MgCl2 • 6H2O), care formează zăcăminte.
Apa mărilor conține aproximativ 3% clorură de sodiu; în mările și lacurile sărate, acest procent este mai ridicat (chiar până la 26%).
Preparare
Clorul se prepară prin mai multe metode.
În laborator se poate obține din acid clorhidric prin oxidare:
O + 2HCl  H2O + Cl2
H2O + Cl2

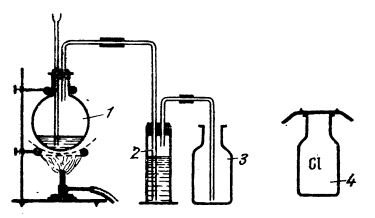
Dispozitiv pentru prepararea clorului în laborator:
1 - balon de reacție; 2 - vas spălător; 3 - vas pentru colectarea clorului; 4 - păstrarea clorului în vas.
Clorul degajat este barbotat într-un vas spălător cu apă în care se dizolvă parțial formând apa de clor; restul se culege, prin deplasarea aerului, într-un vas ținut cu gura în sus. După umplere, vasul se acoperă imediat cu o placă.
Drept oxidant se mai poate folosi permanganatul de potasiu, KMnO4:

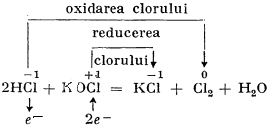
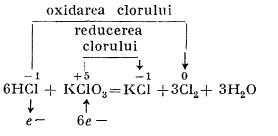
Uneori, clorul se mai prepară în laborator, în cantități mai mari, folosindu-se drept oxidant clorura de var, Ca(ClO)2 (pentru preparare se folosește apartul Kipp):
4HCl + Ca(ClO)2  CaCl2 + 2Cl2 + 2H2O
CaCl2 + 2Cl2 + 2H2O
Procedeul de oxidare a acidului clorhidric cu bioxid de mangan (procedeul Weldon), precum și procedeul de oxidare cu oxigenul din aer (procedeul Deacon) nu mai sunt astăzi folosite în industrie aproape deloc, fiind mai neeconomice decât procedeele electrochimice.
Clorul rezultat din fabricație, după purificare și uscare, este trecut în compresoare și lichefiat la 8 atm. Pentru transport se încarcă în tuburi de oțel ("bombe") sau vagoane cisterne.
Proprietăți fizice
Clorul este un gaz galben-verzui, cu miros înțepător și sufocant. Este de 2,4 ori mai greu decât aerul; de aceea poate fi cules în vase ținute cu gura în sus.
Clorul este solubil în apă (3,1 vol. de clor în 1 vol.apă, la 10°C) formând apa de clor.
Proprietăți chimice
După fluor, clorul este cel mai reactiv element; el se combină direct cu majoritatea elementelor. Nu se combină direct cu azotul, oxigenul și carbonul.
Reacția clorului cu metale
Cu foarte multe metale formează cloruri. De exemplu, dacă se încălzește sodiu în curent de clor, are loc o reacție violentă, însoțită de o flacără galbenă, și rezultă clorura de sodiu. Chiar metalele care în stare compactă și la temperatură obișnuită reacționează lent sau aproape deloc cu clorul - ca de exemplu fierul și cuprul - când sunt sub formă de pulbere fină sau strunjituri, se combină energic cu el. Astfel, dacă într-un vas umplut cu clor se introduce strunjitură de fier încălzită puternic în prealabil, strunjitura se aprinde, împăștiindu-se incandescentă sub formă de scântei. Vasul se umple cu un fum de culoare brună format din particule de clorură ferică, FeCl3.
Practic, clorul nu se combină cu metale prețioase.
Clorul umed este mult mai reactiv decât cel uscat (în acest caz, apa are rol de catalizator). De aceea, clorul, pentru a fi comprimat în cilindri de oțel, sau trecut prin conducte de fier, trebuie, în prealabil, bine uscat.
Reacția clorului cu nemetale
Clorul are mare afinitate pentru hidrogen; un amestec echimolecular de clor și hidrogen, la temperatura obișnuită și în prezența luminii, reacționează energic cu formare de acid clorhidric.
Clorul se combină cu dezvoltare de căldură și chiar de lumină cu fosforul, arsenul, antimoniul, sulful, etc dând naștere la clorurile respective.
Reacția clorului cu apa
Clorul introdus în apă, parțial se dizolvă, parțial reacționează cu apa, formând acid clorhidric, HCl, și acid hipocloros, HClO, care constituie așa-numita apă de clor. Aceasta se descompune cu timpul în acid clorhidric și oxigen:
Cl2 + H2O  HCl + HClO
HCl + HClO
HClO  HCl +O; 2O = O2
HCl +O; 2O = O2
Cl2 + H2O  2HCl + O; 2O = O2
2HCl + O; 2O = O2
Reacția clorului cu compuși anorganici
Clorul reacționează cu hidroxizii alcalini, formând un amestec de clorură și hipoclorit, solubili:
2NaOH + Cl2  NaCl + NaClO + H2O
NaCl + NaClO + H2O
Clorul poate înlocui bromul și iodul din combinațiile lor:
2Br- + Cl2  2Cl- + Br2
2Cl- + Br2
2I- + Cl2  2Cl- + I2
2Cl- + I2
H2S + Cl2  2HCl + S
2HCl + S
Reacția clorului cu substanțe organice
Din cauza marii afinități a clorului pentru hidrogen, unele substanțe organice care conțin hidrogen ard în clor cu formare de acid clorhidric. Astfel, terebentina, C10H16, în contact cu clorul se aprinde și arde cu flacără fumegândă, datorită carbonului pus în libertate o dată cu formarea acidului clorhidric:
C10H16 + 8Cl2  16HCl + 10C
16HCl + 10C
Proprietăți biologice
Clorul este un gaz dăunător sănătății. El pătrunde în organism prin căile respiratorii. În contact cu mucoasele organismului se combină cu hidrogenul din apa celulelor punând în libertate oxigenul, care acționează, foarte activ, asupra țesuturilor; în același timp se formează acidul clorhidric, care atacă și el organismul. De aceea, prezența în aer a unei cantități mai mari de 0,0001% clor provoacă tusea, iar o cantitate de 0,01%, provoacă intoxicații grave. Intoxicatul trebuie ținut la aer curat și este necesar să i se facă inhalații cu oxigen sau cu vapori de alcool-eter, după gravitatea intoxicației.
La manipularea unor cantități mari de clor, lucrătorii trebuie să aibă la îndemână măști izolante cu rezervoare de oxigen.
Utilizare
Clorul are foarte multe întrebuințări. El este o importantă materie primă în industria chimică, fiind folosit în special la prepararea acidului clorhidric de sinteză, la obținerea hipocloriților - mai ales a clorurii de var - la prepararea tetraclorurii de titan (substanță cu proprietăți fumigene), etc.
Atomul de clor având pe stratul electronic exterior șapte electroni, poate accepta un electron și devine ion monovalent negativ:
Cl + e-  Cl-1
Cl-1
| Număr de oxidare | +7 | +5 | +4 | +1 | 0 | -1 |
| Exemple de combinații | Cl2O7 HClO4 |
HClO3 | ClO2 | Cl2O HClO |
Cl2 | HCl |
Combinațiile clorului cu hidrogenul
Hidrogenul și clorul formează acidul clorhidric, HCl.
Combinațiile clorului cu oxigenul
Clorul poate forma următorii oxizi:
- Cl2O - monoxidul de clor;
- ClO2 - bioxidul de clor;
- Cl2O6 - hexoxidul de clor;
- Cl2O7 - heptoxidul de clor.
Oxoacizii clorului și sărurile lor au următoarele formule și denumiri:
| Oxoacizii clorului | Sărurile corespunzătoare |
|---|---|
| HClO - acidul hipocloros | MIClO - hipocloriți |
| HClO2 - acidul cloros | MIClO2 - cloriți |
| HClO3 - acidul cloric | MIClO3 - clorați |
| HClO4 - acidul percloric | MIClO4 - perclorați |
Cercetări cu raze X au arătat că structura ionilor hipoclorit, clorit, clorat și perclorat este:
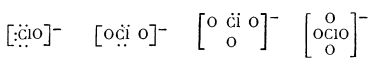
Cu cât oxoacizii clorului conțin mai mult oxigen în moleculă, cu atât crește și stabilitatea lor; deci, puterea de oxidare descrește. Tăria acizilor crește de la acidul hipocloros la acidul percloric.
Preambul
Referințe
1. Edith Beral, Mihai Zapan: Chimie Anorganică, ediția a 3-a, Editura Tehnică, București, 1963
2. John Daintith: Dictionary of Chemistry, 6th edition, Oxford University Press, 2008, ISBN 9780199204632






