Clorura de sodiu, NaCl, cunoscută drept sare de bucătărie, este un solid cristalin și incolor. Este una dintre substanțele cele mai răspândite în natură. Clorura de sodiu are punctul de topire la 801°C, iar punctul de fierbere la 1413°C. Clorura de sodiu are un rol cheie în menținerea echilibrelor electrolitice în sistemele biologice.
Clorura de sodiu, numită și sare de bucătărie, este una dintre substanțele cele mai răspândite din natură. Numai în apa mării există între 2,6-2,9% sare; izvoarele de apă sărate precum și lacurile sărate conțin și ele cantități apreciabile de clorură de sodiu.
Zăcămintele de sare gemă, rămase după evaporarea mărilor sau a lacurilor care au existat în epoci geologice vechi, conțin clorură de sodiu în amestec cu alte săruri ușor solubile, de exemplu clorură de potasiu, KCl, sau clorură de magneziu, MgCl2, sau cu săruri greu solubile, cum este sulfatul de calciu, CaSO4·2H2O (ghipsul), uneori chiar cu argile bituminoase, toate acestea însă în cantități mici. Extragerea sării din mine (saline) se face în galerii sau, uneori, sub formă de saramură.
Apele sărate (saramurile), fie provenite din saline, fie din izvoare de suprafață, sunt supuse concentrării; din ele cristalizează sarea brută. Uneori, apele sărate sunt folosite direct la obținerea clorului și hidroxidului de sodiu (prin electroliză).
În țările bogate în lacuri sărate sau cu ieșire la mare, clorura de sodiu se extrage din saline marine, care sunt bazine așezate la malul mării. În ele se lasă, primăvara, să intre apa mării, care, la căldura solară din timpul verii și la acțiunea vântului, se evaporă. Când soluția s-a concentrat, se pompează în alte bazine, unde este lăsată să cristalizeze. (Din apele mame se mai extrage sulfatul de magneziu, clorura de potasiu, apoi bromuri, carbonați, etc).
În regiunile cu temperatură scăzută, separarea clorurii de sodiu din bazine se face prin înghețare.
Clorura de sodiu destinată consumului alimentar poate fi purificată în mod special prin tratare, în soluție, cu clorură de calciu (pentru îndepărtarea sulfaților) și cu lapte de var (pentru îndepărtarea magneziului și a impurităților organice), după care urmează concentrarea prin evaporare.
Clorura de sodiu cristalizează în cuburi incolore, regulate. Uneori poate conține incluse apă, metan și alte gaze. Dacă se încălzesc cristale de sare, se aud pocnituri provocate de soluția mamă aflată în cristal, care, evaporându-se, crapă cristalul. Se spune că sarea decrepită.
Clorura de sodiu existentă în zăcăminte are uneori o colorație albastră care a fost atribuită prezenței sodiului metalic dizolvat în stare coloidală în sare. Cercetări recente au dovedit, însă, că această colorație albastră este datorată existenței unor electroni liberi care ocupă toate locurile rămase neocupate de ioni de halogeni în rețeaua cristalină. Dovadă este că iradiind clorură de sodiu (cu radiații
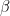
, radiații
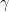
, raze X) se obține aceeași colorație albastră ca cea întâlnită la sarea gemă.
În stare pură, clorura de sodiu nu este higroscopică (umiditatea observată uneori la clorura de sodiu este datorată prezenței clorurii de magneziu).
Solubilitatea sării în apă este în general de 33% și variază puțin cu temperatura.
Întrebuințările clorurii de sodiu sunt numeroase. În alimentație clorura de sodiu este cunoscută și utilizată universal la conservarea și asezonarea/condimentarea alimentelor. Industrial este folosită ca precursor pentru o varietate mare de produși pe bază de sodiu; de exemplu, în procesul Solvay pentru obținerea carbonatului de sodiu, Na2CO3, sau în procesul Costner Keller pentru obținerea hidroxidului de sodiu, NaOH. Clorura de sodiu este de asemenea folosită la prepararea clorului (prin electroliza soluției) și a sodiului metalic (prin electroliza topiturii), la prepararea acidului clorhidric și a sulfatului de sodiu (prin reacția cu acid sulfuric), la prepararea hipocloriților și cloriților (prin electroliză în celule fără diafragmă, unde clorul se amestecă cu hidroxidul de sodiu), în unele procese metalurgice pentru “prăjirea clorurantă”, pentru prepararea apelor minerale artificiale (aproape toate apele minerale conțin o cantitate de clorură de sodiu), pentru prepararea unor glazuri ceramice, în tăbăcărie (clorura de sodiu având acțiune deshidratantă și slab sterilizantă, împiedică dezvoltarea bacteriilor), în amestecuri frigorifice, pentru topirea gheții și zăpezii, etc.
Clorura de sodiu are un rol cheie în sistemele biologice în menținerea echilibrelor electrolitice. Soluția 0,86% de clorură de sodiu pură este folosită în medicină ca ser fiziologic, izotonic cu serul sângeului.






