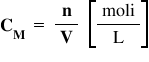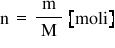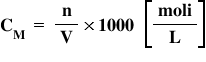Concentraţia soluţiilor. Cristalohidraţi.
Partajeaza in Google Classroom

Transcript
data trecută am vorbit despre faptul
că soluțiile sunt amestecuri omogene
obținute prin dizolvarea a particulelor
de solutii un solizi soluțiile
putând fi lichide gazoase sau solid
și tura trecută am văzut că solubilitatea
unui Salut între un anume solvent
este vreodată de trei factori ce
anume de temperatură de presiune
și de natura solventului solubilitatea
fiind cantitatea de sare se poate
dizolva într un volum de solden
în anumite condiții dar fie că
e vorba despre aerul pe care respirăm
despre Apa dintre un lac sau despre
o soluție de acid dintre un laborator
ceea ce contează cel mai mult despre
o soluție este cât de mult soluți
se află în acea soluție ce folosesc
des termeni precum soluție diluată
sau soluție gata Dar Aceștia sunt
termeni bagi în chimie trebuie
să fim întotdeauna foarte exact
în ceea ce privește cantitățile
pentru asta Putem Descrie o soluție
în termeni de concentrație molară
sau de concentrație procentuală
Sunt convinsă că ați mers la piscină
sau la bazin măcar o dată mie așa
sigură simțit un ușor miros de
clor milioanele de microorganisme
care trăiesc între o piscină folosită
de mulți oameni pot reprezenta
un risc mare de aceea apa e dezinfectată
cu dacă concentrații aia de clor
ar fi prea mică clorul nu ar mai
fi la fel de eficient iar noi Na
putea trezi cu tot felul de infecții
după o vizită la bazin în schimb
dacă concentrația de clor prea
mare atunci da putea întoarce de
la piscină cu iritații pe piele
și cu ochii roșii Așadar concentrația
soluțiilor E extraordinar de importantă
Chiar și în afara laboratorului
de chimie mai exact concentrația
reprezintă cantitatea de stent
pentru anumită cantitate de soluție
de asemenea și în calculele stoechiometrice
este necesar să cunoască numărul
de molecule sau de Ion de solut
care există între o cantitate de
soluție asta deoarece stoechiometrie
studiază relațiile cantitative
dintre elemente reacțiile chimice
pe care le vom întâlni de acum
încolo please pe care le vom întâlni
atât în laboratorul de chimie dar
și în bucătărie sau în alte locuri
unde nu va fi trecut prin cap că
vă trebuie cunoștință de chimie
să vedem acum Ce reprezintă cele
două tipuri de concentrații despre
care am pomenit mai devreme si
Cum ne putem folosi de ele în lemnele
de chimie concentrația procentuală
a unei soluții reprezintă masa
de soluție dizolvată în 100 de
grame de soluție și se notează
cu c și semnul procent de obicei
masa de soluție se notează cu m
indice s iar masa de soluție Notează
cu m d de la masa de substanță
dizolvată sau de la masa de dizolvat
De ce concentrația procentuală
este masa de soluție de în 100
de g de soluție iar formula care
susțin această definiție este aceasta
masa de soluție masa de soluție
100 este egal cu valoarea concentrației
procentuale în cele 100 de g de
soluție intră atât masa solventului
cât și masă a solului De exemplu
o soluție de clorură de sodiu 30%
conține 30 de g de clorură de sodiu
în 100 de grame de soluție Deci
masa de solvent este egală cu 100
minus 30 deci avem 70 de g de solvent
pentru a calcula concentrația procentuală
a unei soluții sau pentru a prepara
o soluție de o anume concentrație
procentuală putem proceda în două
moduri putem fi să folosim relația
de calcul sau putem să folosim
regula de trei simple pornind de
la definiția concentrației procentuale
și să aflăm mărimea de care avem
nevoie în lecția viitoare vom exemple
de calcul și vom vedea că e foarte
simplu să lucrăm cu concentrație
mai departe molaritatea a sau concentrația
molară a unei soluții reprezintă
numărul de moli de soluție se dizolvă
un litru de soluție concentrația
molară este notată cu Ce indice
n molul este prietenul cel mai
bun al chimiștilor și asta Datorită
lui avogadro despre care am mai
discutat în primele lecții chimice
sunt atât de așa de mult pentru
că acesta face trecerea de la dimensiunea
incredibil de mică A atomilor și
moleculelor spre lumea vizibilă
deși totul din lumea care ne înconjoară
se întâmplă la nivel molecular
datorită molului reacțiile chimice
sunt mai ușor de înțeles și de
explicat iar concentrația molară
ne oferă relație matematică foarte
simplă prin care putem lucra cu
molii să vedem mai exact despre
ce relație este vorba conform definiției
avem un litru de soluție care conține
o anume concentrație de moli de
soluție de centru în volum necunoscut
avem un număr n de moli de solut
iar prin regula de trei simpla
care e întradevăr foarte simplă
vă reamintesc că produsul unei
diagonale este egal cu produsul
celeilalte diagonale iar din ăla
ce matematică obținută scoatem
Termenul care ne interesează Deci
conform acestor reguli produsul
dintre numărul n de moli de soluții
un litru de soluție este egal cu
produsul dintre concentrația molară
și volumul necunoscut din această
relație a am de dus formula a concentrat
simulare Ce anume concentrația
molară este egală cu numărul de
moli supra n reprezintă numărul
de moli de soluții se calculează
împărțind masa de soluție la masa
molară a solului e mare masă de
soluție Sta fi dată de datele problemei
fie reprezintă o necunoscută problema
iar masa molară o putem calcula
singur folosind tabelul periodic
În astfel de calcule este extrem
de important să ținem cont de unitățile
de măsură de exemplu dacă Lucrăm
în mililitri trebuie să ținem cont
că definiția concentrației molare
Precizează un litru de soluție
de va trebui să ne reamintim că
1 L este egal cu 1.000 de ml În
consecință și formula concentrației
molare se va modifica puțin și
să vedem Cum anume ne gândim că
între 1.000 de ml de soluție avem
o anume concentrație molară de
solut iar între un volum de soluție
necunoscut toate mililitrii avem
un număr n de moli de soluție regula
de trei simpla vedem că formula
concentrației molare când lucrăm
este aceasta concentrația molară
este egală cu numărul de moli de
soluții Bravo linie iar unitatea
de măsură fiți atenți a rămas tot
moli supra litru asta pentru că
am introdus o mie în formulă Așadar
o soluție de acid clorhidric 2
molar conține doi moli de acid
clorhidric pentru un litru de soluție
și înainte de a trece la lecția
cu exemple de calcul trebuie să
vă mai zic că atunci veți intra
întru laborator și veți citi tichetele
de pe sticluțele cu substanțe chimice
veți observa următorul lucru în
cazul anumitor substanțe precum
sulfatul de cupru acolo unde scrie
formula chimică și masa molară
a substanței din sticlă nu scrie
că masa molară a sulfatului de
cupru este egală cu 150 și 9 G pe
Mol și veți vedea că pe etichetă
scrie că masa molară a sulfatului
de cupru ori cinci molecule de
apă este egală cu 240 și 9 G pe
Mol la fel în cazul clorurii de
Cobalt pe sticle trecută următoarea
valoare masa molară a clorului
de Cobalt șase molecule de apă
este egală cu 307 9 grame pe Mol
asta înseamnă că aceste substanțe
care sunt solid conțin apă de cristalizare
substanțele se numesc cristalohidrat
și sunt de fapt substanțe ionice
care înglobează în structura lor
molecule de apă să luăm exemplul
cristalohidratului de sulfat de
cupru Acesta are culoarea albastră
dacă ținem o sticlă de ceas cu
cristalohidrat deasupra unei flăcări
observăm că în scurt timp se va
decolora din albastru în el asta
înseamnă că moleculele de apă din
cristal sau evaporat deci acum
sticla de ceas conține sulfat de
cupru ani hidro anhidru este un
termen care desemnează absența
apei din compoziția unei substanțe
dacă peste aceste cristale de sulfat
de cupru anhidru vom adăuga câteva
picături de apă cristalele peste
care picură apa vor deveni din
nou albastre pierderea apei de
cristalizare totală sau parțială
duce la modificarea unor proprietăți
fizice și la modificarea masei
molare Deci orice modificare a
trage și consecinte există cristalohidrat
care pierd Cu timpul o parte din
apa de cristalizare chiar dacă
nu sunt ținuți la caldi această
proprietate se numește inflorescență
de exemplu sodă de rufe care are
formula carbonat de sodiu orz 10
molecule de apă pierde o parte
din apa de cristalizare în timp
și devine ca o pulbere impotriva
substanțe apă din atmosferă Adică
foarte ușor umezeala din a proprietate
care se numește higroscopicitate
un exemplu de substanță higroscopică
este hidroxidul de sodiu solid
ba chiar și mierea este o substanță
higroscopică pentru că acum știm
ce reprezintă Concentrația unei
soluții și știm cum o putem exprimă
cât mai precisă lecția viitoare
vom vedea cum putem aplica aceste
cunoștințe în probleme