Coroziunea. Prevenirea coroziunii.
Partajeaza in Google Classroom

Transcript
la fel ca toate lucrurile cu care
ne confruntăm în viața de zi cu
zi și reacțiile redox au părțile
lor bune și mai puțin bune coroziunea
este una din reacțiile redox nedorite
în coroziune înțelegem un ansamblu
de procese care duce la degradarea
superficială adică la suprafață
sau la deblocarea în adâncime a
unui metal sub acțiunea diverșilor
factori Imperiul exterior Oțelul
și mai ales fonta se corodează
o foarte ușor astfel încât aproape
12% din fierul oprit anual se transformă
rugină coroziunea oxidarea nedorita
metalelor care îi scurtează viețile
produselor din oțel precum poduri
sau vehicule în fiecare Ioan industria
și societatea plătesc sume imense
de bani pentru o locuire a componentelor
metalice corodare și totuși nu
toate reacțiile de coroziune sunt
nedorite stratul oxid de subțire
de cu are verde de pe acoperișurile
de cupru poate face ca o grădină
să arate frumos coroziunea fierului
adică ruginirea lui este o cale
foarte comună prin care sunt distruse
foarte multe din obiectele din
jurul nostru în continuare vom
vedea ce se întâmplă de fapt atunci
când apare rugină fierul ruginește
când intră în contact cu aerul
umed Deci cu aer care contine atât
oxigenului tomii de fier din bucată
de metal sunt oxidarii a pierde
electroni și devin Ion pierdut
acești Ioni fier 3 se vor legat
de niște Ion oxigen 2 fost și apoi
vor fi depozitat sub formă de oxid
roșu brune adică Oxid feric cu
această formulă chimică dar ca
să obții de fier este de fapt gratar
adică există și molecule de apă
încorporate în structura finală
a oxidul fierului este chiar procesul
invers valorile lui din minereuri
său care e în general diferit de
obținere a fierului din minereuri
în care se găsește în natură necesită
costuri foarte mari având și consecințe
negative asupra mediului înconjurător
bineînțeles e foarte neplăcut când
după atâta efort și daune fierul
se transformă la 9:00 că nu îi
sperii așa dar înțelegerea procesului
de coroziune găsit metode de Prevenire
să vedem acum ce se întâmplă mai
exact în interiorul unei picături
de apă de suprafață emos putem
admira modul în care se sincronizează
atomi care iau parte la procesul
de ruginii la marginea picăturii
de apă apare moleculele de oxigen
din aer care își fac loc printre
moleculele de apă acest lucru în
electronice violent când vasele
de molecule de oxigen atingeți
suprafața fierului își va lua pur
și simplu electroni de la un atom
de fier descoperit cu doi Electro
pierduți fierul.de vine Ion Fier
2 plus se destinde despre față
și este imediat înconjurat de mai
multe molecule de apă iar deformați
se va transforma imediat atomi
de la marginea picăturii de apă
duc o viață destul de interesant
imediat se formează ionul Fier
2 plus sau chiar în timp ce se
formează apare o undă rapidă de
curent electric rezultatul electronilor
care circulă prin metal acest electroni
vin de la atomi de fier care se
află aici în zona centrala picături
de apă unde nu e atât de mult oxigen
din aer aceștia Tom de fier de
aici tu donează electronii și de
Vino aici la rândul lor Ion fier
doi electroni pe care ia venit
dracii greață până la marginea
picăturii se lipesc de ani fierbe
plece de acolo și îi Transformă
la loc în atomi de fier beton Așadar
vedem că de fapt atomi de fier
din această regiune centrală mai
puțin oxigenată sunt cei care sunt
convertiți Dar pierdui aici mușcă
Deci coroziune să ne întoarcem
puțin la momentul în care o moleculă
de oxigen la furat de la un atom
de fier aici la marginea de electroni
Transformă molecula evazivă de
oxigen în doi Ioni oxigen 2 imediat
foarte periculoși de oxigen sunt
formați aceștia fură Proton de
la Ion hidroniu care se întâmplă
să fie în vecinătate iar acum atât
Ioni hidroniu cât și Ioni de oxigen
din molecule de apă care se pierde
anonime prin mulțimea celorlalte
molecule de apă pentru formarea
apei din molecule de oxigen sunt
Deci luați din soluția înconjurătoare
în special dacă această picătură
acidă și Deci bogat pentru o da
dar ce se întâmplă la marginea
picăturii de apă așa că acum ne
vom îndrepta atenția spre care
au loc în partea centrală a picăturii
acolo unde Metalul este codat atom
cu atom Să ne amintim că atomi
de fier din această zonă și au
cedat electronilor fier vechi de
la margine a deveni la rândul lor
Ion Fier 2 plus în timp ce aceștia
se formează este detașează de suprafața
metalică și sunt înconjurați de
molecule de apă aceștia vor mai
trece prin câteva aventuri care
vor duce la formarea lunii când
fierbe ăștia că înjurați de apă
aceștia lasă în urma lor cavități
nici în suprafața metalului însă
Nici acesta nu îți prea viețuiesc
mult chiar dacă În această regiune
a picăturii de apă există mai puțin
oxigen aceste molecule există totuși
aici și sunt la fel de dormit de
electrică molecule de oxigen vor
furai electron chiar și de la Ione
pierde huse Transformând Union
fier 3 la rândul ei după ce a furat
o negură de oxigen se transformă
în Dorian de oxigen e o mare diferență
între cesa întâmplat cu Ione oxigen
2 minus la marginea picături și
ce se întâmplă cu acest caz Ioni
fier 3 plus încărcat cu o sarcină
puternic pozitivă se formează imediat
lângă Ianis oxigen 2 se formează
o atracție puternică între atracție
datorată sarcinilor electrice opuse
în timp ce Ion Se apropie pentru
a forma oxidul feric e captează
și molecule de apă și de alta a
acestei particule de oxid feric
hidratat și plin de impurități
constituie rugii acum că am înțeles
ce înseamnă putem să ne gândim
și la metode de Prevenire acestei
metode de protecție anticorozivă
sunt foarte importante pentru conservarea
Rareș energetic ale omenirii simplă
și ieftină metodă de protejare
a metalelor împotriva coroziunii
este acoperirea cu vopsea vopseaua
izolează suprafața metalică însă
metoda eficienta Numai atâta timp
cât nu aparțin stratul de vopsea
dacă apare o zgârietură oricât
de mică în acest strat de dedesubt
rămâne neprotejat o metodă care
Rezolvă această problemă este acoperirea
metalelor cu un strat de ce se
mai numește și pasivare procedeul
este relativ costisitor dar eficaci
Cele mai folosite metale pentru
acoperire electrolitice sunt argintul
aurul Omul e chelul zincul cuprul
și staniul cea mai eficientă metodă
dar și cea mai costisitoare este
obținerea de aliaje cu alte metale
aliajul obținut are o rezistență
fizică și chimică mult mai mare
decât fiecare metal individualizare
a este protejarea fierului cu 10
dacă apare o zgârietură în stratul
de zinc de pe suprafața unei bucăți
de fiecare vanitate atomi de fier
de de desfăcut expuse aerului și
celorlați paturi exterior la și
un atom de fier este atacat de
oxigen o bat la marginea unei de
această dată în atom de electroni
nu mai vin de la exatlon de fier
din regiunea centrala picături
de apă ce vin de la un atom de
zincare se apropie de electroni
și va transforma ionul de fier
de plug care se formează la loc
un atom de fier înainte ca avionul
să aibă astfel fierul este citează
iar obiectul nostru tatal va avea
o viață nu este posibilă organizarea
structurilor metalice mari cu vapoare
subterane sau Podul metalice se
poate folosi știind Protecția catodică
de exemplu umbla pentru un metal
mai reactiv decât fierul de ce
nu dormi De obicei poate conecta
prin cablu conductor la auzit de
RAR în timp ce fierului sunt furați
electronii de către molecule de
oxigen locul metalic alimentează
fierul cu electroni prin cablu
conductor astfel aceștia electroni
formarea Ioni Fier 2 plus dacă
păstrez intensitatea structurii
de fier o să prinzi metalică resimțit
locul metale care numește anulează
țeava de fier iar înlocuirea lui
relativ ieftine Deci dacă ați fost
atenți lecția aceasta știți acum
la 12:00 și mai știi există mai
multe metode de protecție anticorozivă
Încetează

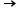 2 Fe2O3 x nH2O + 8H+
2 Fe2O3 x nH2O + 8H+




