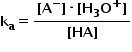Echilibre acido-bazice. Tăria acizilor. Exponentul de aciditate - Partea a II-a
Tag-uri
Partajeaza in Google Classroom

Transcript
Necula unui acid hidrogenul este
legat de un nemetal notat aici
cu ei printre o legătură covalentă
polară de aici Aceasta este o legătură
covalentă polară iar săracii de
această formă este influențată
de polaritatea și de Tăria legăturii
hidrogen de metal dar și de stabilitate
a anului A minus care se formează
după pierderea plutonului dacă
atomul de hidrogen Se poate desprindem
foarte ușor de metal atunci acidul
este clasificat ca fiind una ce
tare Haide să ne reamintim și ce
sunt acizii cu cât această legătură
covalentă este mai polară și mai
slabă cu atât baza conjugată a
minus va fi mai stabilă și Deci
mai slabă fi instabilă înseamnă
că Nu captează plutonic cu atâta
ușurință delectare și cu cât această
bază a minus este mai slabă cu
atât acidul este mai tare așa dar
vedem că există o legătură foarte
importantă între cinci și Daria
bazei sale conjugate un acid tare
duce la formarea unei bazei conjugate
silabe și această baza conjugată
silabă are o afinitate foarte scăzută
pentru protoni și este mult mai
slabă decât apa caz în care logic
moleculele de apă vor câștiga competiția
pentru Ioni de hidrogen din vasul
de reacție Deci vedem că una citare
poate fi descris drept un acid
care are o baza conjugată mult
mai slabă decât a unui acid este
de fapt infinită de Direcția în
care se deplasează echilibrul reacției
de disociere a acidului respectiv
echilibrul este deplasat Acum plec
spre dreapta în cazul unui acid
tare și este plasat foarte mă spre
stânga în cazul unui acid slab
acizii foarte tari foarte ușor
Proton iar disocierea lor în apă
este practic o reacție completă
asta înseamnă că echilibru toate
sau aproape toată moleculele de
acid tare sunt complet disociate
de aceea echilibru întâlnim nu
mai asiști Ioni și molecule de
acid tare în schimb vedem că în
cazul acestei lor si la Billa echilibru
întâlnim în marea majoritate moleculele
de acid slab și vedeam că foarte
puțini dintre aceste molecule au
disociat în Ion Yaman news sau
Ion hidroniu astfel spunem că în
cazul unui acid slab echilibrul
reacției de disociere este deplasat
spre stânga să scrie ma cum și
reacția de disociere a unui acid
observăm că Singurul lucru care
se schimba fata de ecuația precedentă
este această săgeată care după
cum știm de la reacțiile despre
echilibrul chimic reprezintă faptul
că echilibrul sa deplasat compresele
dreapta Deci că acidul nostru a
disocia complet în apă conform
legii alții unii maselor Constanța
de echilibru aceste reacții exprimată
în funcție de concentrațiile molare
valoarea acestei constante de echilibru
este extrem de mare asta deoarece
după cum am spus acidul tare disociază
complet sau aproape complet lucrurile
stau cu totul altfel atunci când
este vorba despre acesta ecuația
reacției de ionizare a unui acid
slab este aceasta și vedem că este
reprezentat cu săgeată dublă Ce
semnifică după cum am discutat
mai devreme faptul că la echilibru
o neculele de aici se vor găsi
aproape ne disociate sau disociate
foarte foarte puțin este diferența
de aciditate un acid slab formează
o baza conjugată tare așa dar în
cazul ecuațiile reacției noastre
cuplu la 5:00 baza conjugată a
ionul A minus reprezintă un acid
și o bază conjugată tare această
baza conjugată este mai tare decât
apa Deci afinitatea foarte mare
pentru Proton astfel că atunci
când aveți o formează ionul hidroniu
și baza conjugată baza conjugată
fiind foarte instabilă va fura
repede protonul înapoi și va reforma
acidul pentru a determina Tăria
unui accident în soluție apoasă
există o măsurătoare cantitativă
și anume Constanța de aciditate
pe care o notăm cu A aceasta este
de fapt o constantă de echilibru
specifică pentru disocierea acizilor
în apă Deci scrie expresia constantei
de echilibru pentru reacția de
ionizare a unui exces de formă
a a în general concentrația apei
este cu mult mai mare decât concentrația
acidului slab în plus deoarece
acidul slabo ionizează foarte foarte
puțin concentrația apei suferă
o modificare neglijabilă de aceea
concentrația apei este tratată
drept o constantă și e constantei
de echilibru se simplifică prin
înmulțire a lui ca cu concentrația
apei Deci avem Constanta ori concentrația
apei egal cu exagerează de mai
devreme simplifică concentrația
apei și astfel obține expresia
constantei de aciditate ca ei de
toate acestea reprezintă concentrației
molare la echilibru cu cât concentrația
molară a ionilor hidroniu este
mai ridicată cu atât este mai mare
valoarea constantei de aciditate
și cu atât acidul este mai tare
vedem Așadar că Constanța de aciditate
este o unealtă bună pentru a măsura
a citi lor la diferență de acizi
tari în cazul acelor slabit această
constante de aciditate are valori
extrem de mici de aceea de foarte
multe ori valoarea constantei de
aciditate se exprima sub formă
de pe ca a Care este exponentul
d aciditate aceste este exact același
operator matematic pe care îl cunoaștem
de la pe H Deci este egal cu minus
logaritm zecimal Așadar pe ca a
este egal cu minus logaritm zecimal
din Constanța de aciditate pe ca
se folosește mult mai mult în practică
decât ca soarece valorile lui ca
ei au mult prea multe zecimale
în cazul acestei lor sunt acuma
nu mai devreme sunt valori extrem
de mici iar catul lor tari au valori
mult prea mare de exemplu ca ei
pentru disocierea acidului sulfhidric
Care este un acid tare este egal
cu 10 la puterea a 11-a moli pe
litru iar pe ca ei pentru același
acid este egal cu 1000 News ogarii
din 10 la puterea 11 a și este
egal cu minus 11 Constanța de aciditate
pentru acidul acetic Care este
un este egală cu 1 ori 10 la minus
5 moli pe litru iar pe ca ei tot
pentru acidul acetic este egal
cu 4 e clar că este mult mai ușor
să lucreze cu aceste valori decât
cu acestea Cu cât este mai mare
valoarea lui pe ca ei cu atât Acidul
de asociat mai puțin Union sau
cu alte cuvinte cu cât valoarea
lui a este mai mare iar valoarea
lui pica a este mai mică cu atât
acidul este mai tare așa dar vedem
că există mai multe căi de a descrierii
acizii am pregătit aici un tabel
care să vă ajute să recapitulat
informația din această lecție de
aceste un tabel despre Tăria acizilor
și Dacă tot am vorbit atâta despre
ai citit arși ai citit lot Haideți
să vedem și câteva exemple există
șase acizi care sunt considerați
acizi tari acidul clorhidric acidul
bromhidric și acidul iodhidric
Aceștia sunt acizi ai halogenilor
și exciziei acid azotic acid sulfuric
și acidul percloric există mult
mai mulți acizi slabi decât aici
Stai Haide să vedem câteva exemple
avem acidul clorhidric acidul acetic
acidul fosforic și încă un exemplu
a fi acidul carbonic dacă în această
lecție ai întâlnit noțiune clare
precum echilibrul chimic sau Constanta
de echilibru se pot revizui În
capitolul mit echilibru a mic de
la clasa a noua sau din secțiunea
chimie Generală de asemenea a noțiunilor
de acizi și baze clasificarea lor
pe H cale de pe H pastile bizuit
În capitolul soluții apoase de
acizi și baze tot de la clasa a
noua sau din secțiunea chimie generală

 A-(aq) + H3O+(aq)
A-(aq) + H3O+(aq)