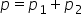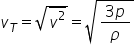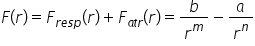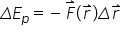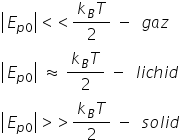Extinderea modelului gazului ideal. Stările de agregare.
Tag-uri
Partajeaza in Google Classroom

Transcript
încet da șaptea lecție de termodinamică
vom continua și termina discuția
noastră despre teoria cinetico
moleculara să luăm în discuție
o aplicație practică a am dori
cinetică moleculare și anume legea
dalton din termodinamic în particular
Să considerăm două gaze amestecate
care formează un sistem termodinamic
energia cinetică medie a amestecului
de gaze va fi prin definiție Digi
Energy cinetică medie prin definiție
sta întotdeauna suma tuturor energiilor
cinetice ale moleculelor sau atomilor
din substanță unde deci în este
numărul total de molecule din provenind
din cele două gaze mestecat împărțită
la numărul de molecule aceste definiția
valorii medii a oricărei parametrul
în particular în acest caz energia
cinetică a unei molecule dar gazul
nostru este format din amestecul
de două gaze Deci numărul total
de molecule va fi egal cu suma
am numărul de molecule individual
Deci energia cinetică medie va
avea această formulă despărțită
în mele pe negi cinetice ale celor
două gaze ce formează amestecul
în continuare această relație poate
fi scrisă în felul următor unde
am folosit ecuația pentru energia
cinetică a unui atom sau moleculă
energia cinetică este masa ori
viteza la pătrat împărțit la 2
toate moleculele de același tip
au aceeași masă Deci toate moleculele
de tipul 1 vor avea masa m-1 toate
moleculele de tipul 2 va avea masa
im2 dar vitezele lor bineînțeles
vor știi diferite toată molecule
au viteze diferite între ele în
concluzie sub ma se scrie în felul
următor și bineînțeles din definiția
mediei unui parametru din nou De
ce aplicăm aceeași definiție ca
acea pentru mediane cinetice dar
în acest caz pentru viteza la pătrat
și atunci putem scrie că energia
cinetică medie este unul pe an
1 plus 2 înmulțit cu 1 pe 2 iar
această sumă va deveni în 1 înmulțit
cu Vita media vitezei la pătrat
a moleculelor de tipul 1 Deci din
nou am folosit faptul că în acest
caz media viteze la pătrat prin
definiție este 1 supra n sumă din
z pătrați cu e de la 1 la ea și
obținem această ecuație apoi putem
folosim ecuația generală pentru
energia cinetică medie Care este
3 pe 2 Constanța boltzmann ore
temperatura aceasta este valabilă
pentru orice tip de caz această
ecuație poate fi scrisă ca 3 pe
2 Constanța universală a gazelor
mulți tool cu temperatura împărțită
la numărul lui avocatul această
din definiția constantei boltzmann
și mai departe folosind ecuația
generală a gazelor putem scrie
Acest această cantitate ca 3 pe
2 înmulțită cu produsul dintre
presiune și volum împărțită la
numărul de kilomoli înmulțit cu
numărul e avocat din nou această
rezultă din ecuația generală acasă
care spune că pev este egal cu
n u r t și în final putem scrie
ecuația cinetică medie a unei molecule
ca fiind 3 pe 2 pe V împărțit la
numărul total de molecule în numărul
de kilomoli înmulțit cu numărul
lui avogadro prin definiție este
n care este în unu plus în doi
din aceste Două ecuații obținem
că 3 pe 2 TV este egal cu 1 pe
2 înmulțit cu M1 n1 Z1 pătrat medium
plus m2n 2 v-2 pătrat meciul în
singur lucru ca la făcut în acest
pas a fost să simplificăm unul
pe an 1 plus N2 care e prezent
în ambele părți ale egalități rezultă
imediat că TV sau mai exact pe
direct presiunea deci putem simplifica
doar un și obține un 1 pe 3 iar
în paranteză Trebuie doar să mai
împărțim cu volumul iar numărul
n 1 împărțit la Z vada in unul
mic densitatea sau numărul de molecule
pe unitatea de volum de ce avem
in 1 m 1 v-1 pătrat mediu plus
m2 m2 V2 pătrat meci în concluzie
am demonstrat că pe presiunea totală
este egală cu presiunea parțială
a gazului 1 plus presiunea parțială
a gazului 2 acestea sunt 1 pe 3
in 1 m 1 v-1 pătrat mediu este
exact pe 1 din ecuația fundamentală
a teoriei cinetico moleculare în
concluzie am demonstrat legea dalton
care în forma ei din termodinamică
este ca și orice lege de termodinamică
stabilită experimental care spune
că intru în amestec de două case
presiunea totală egală cu suma
presiunilor parțiale exercitate
de fiecare componentă gazoasă în
parte independent de prezenta celorlalte
numai că noi în cadrul teoriei
cinetică moleculare am demonstrat
o matematică aceasta este valabil
cu toate sau pentru toate legile
termodinamicii sunt demonstrat
experimental în termodinamică dar
sunt demonstrat a Teoretic în fizica
statistică teoria cine de comori
fiind un caz de particular al fizicii
statistice alt subiect este legat
de m așa numita viteză termică
a gazului din ecuația fundamentală
a termodinamicii știind că pe este
egal cu 1 pe 3 din înmulțită cu
densitatea gazului înmulțită cu
viteza medie a pătratului viteze
de aici rezultă că radical din
Media pătratului vitezei va fi
radical din de triplul presiunii
împărțit la densitate această cantitate
se numește viteză termică a gazului
iar întradevăr unități de metru
pe secundă și de o estimează de
o cuantificare a gradului de agitație
termică prezentă în casă Interesant
este dacă calculăm această cantitate
această viteză termică pentru un
gaz de hidrogen aflat în condiții
normale Adică o presiune presiunea
egală cu o atmosferă Care este
10 la a cincea Pascal și temperatura
de 273 grade Kelvin adică 0 grade
Celsius putem măsura pentru acest
gaz în aceste condiții de presiune
și temperatură Care este densitatea
și obținem această valoare înlocuind
acești parametri în ecuația vitezei
termice obținem o viteză termică
surprinzător de mare și anume de
1 km pe secundă aceasta este viteza
moleculelor de hidrogen în condiții
normale de temperatură și presiune
aia inițial a fost considerată
greu de crezut și considerată un
test alte oricine Tico moleculare
până când întradevăr în 1920 a
fost măsura experimental și verificată
că între adevăr este atât de mare
în concluzie teoria genetică moleculară
și modelul de la baza a Care este
modelul gazului ideal a fost verificat
destul de extensiv și sa tras concluzia
că este un model bun Întrebarea
este Până la ce punct presupunerile
cele patru presupuneri sau ipoteze
care stau la baza ideal sunt corecte
realitate Deci întrebarea se pune
în ce caz este necesar să extindem
acest model la gazul ideal pentru
al face corect în realitate asta
din moment ce am văzut că în multe
cazuri el întradevăr funcționează
un prim răspuns la în văzut de
așa și anume În cazul în care moleculele
sau atomi au dimensiuni neglijabile
bună din presupunere la că dimensiunile
atomului sau un particulara molecule
pentru că ele sunt mai mari sunt
neglijabile da bineînțeles să avem
în multe situații avem de a face
cu molecule suficient de mari ca
această presupunere să nu mai fie
corectăm și în acest caz prima
extindere a modelului gaz ideal
este considerarea unui număr de
grade de libertate mai mare decât
3 va duc aminte numărul de grade
de libertate e este egal cu 3 dacă
considerat numai coordonatele de
translație ale mișcării x y și
z totuși dacă molecula e suficient
de mare atunci iar și alte mișcări
în interiorul gazului decât translația
Spre exemplu se poate roti in jurul
axei proprii deci putem considera
Spre exemplu rotația moleculelor
iar pentru anumite de rotație și
anume cea cu o axă rigidă cu cu
distanța dintre atomii molecule
lichide e va fi egal cu 5 putem
considera și alte tipuri de mișcări
ale moleculei și atunci trebuie
să creștem acest grad de libertate
acest număr de libertate În consecință
o extensie mai semnificativă a
modelul gazului de el are legătură
cu distanța dintre molecule Dacă
vă duceți aminte un o altă presupunere
din modelul gazului de el era că
distanța dintre molecule este mult
mai mare decât dimensiunea moleculă
Evident în pentru gazele aflate
la presiune joasă aceasta este
adevărat dar odată ce crește presiunea
gazului și cu atât mai mult o dată
și Considerăm lichide sau solide
atunci distanța dintre molecule
de vine comparabilă cu dimensiunea
moleculelor Care este de ordinul
unui nanometru Neciu nanometru
este nanometru este de ordinul
10 la minus 9 metri în acest caz
nu mai putem considera că nu există
interacțiuni între molecule Deci
în acest caz trebuie să introducem
să extindem modelul cazului introducând
forțe de interacție dintre molecule
aceste forțe de interacție au fost
măsurate și calculate ele sunt
destul de complexa vând atât o
componentă repulsivă de respingere
f r cât și o componentă de atractiv
de atracție f a forma lor generală
este invers proporțională cu o
putere a distanței și bineînțeles
semnul forței este dat de tipul
a o forță atractivă este negativă
o forță Eva este pozitiv ca să
Reprezentăm grafic rezultă că Forțele
de interacțiune molecule au această
formă generală Deci forța ca funcție
de distanță distanța intra moleculară
Deci iar un minim și apoi timp
de către 0 Cele două componente
ale ei fiind una repulsiv aceasta
acesta este f r și una atractivă
Care este negativ a câteva comentarii
observăm că la distanțe foarte
mici forța repulsivă domină și
Deci moleculele se resping la distanțe
mari forța atractivă domină și
atunci molecule încep să se tragă
Există o distanță pe care o notăm
cu 0 în care cele două devin comparabile
și forța are un caracter mai complex
acest această forță care este de
natură electromagnetică este o
forță conservativă aceasta dacă
va duceti aminte din lecția de
dinamică în care am discutat forțe
conservativ a înseamnă că variația
energiei potențiale este egală
cu lucrul mecanic de ce este egal
cu produsul dintre Forța F din
intra moleculară și deplasare a
produse de ea aceasta înseamnă
că energia potențială va avea o
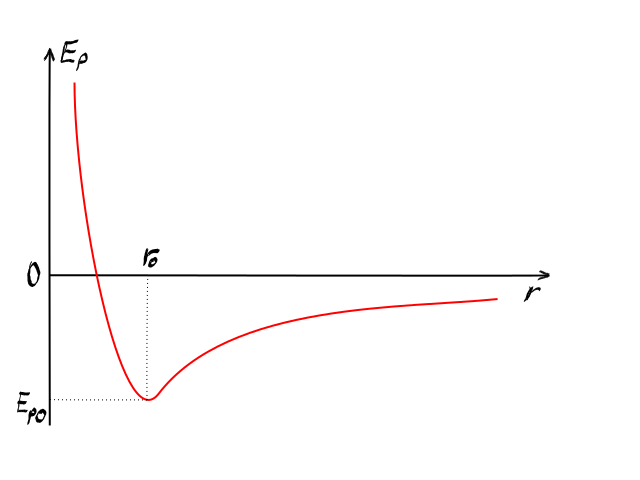
formă similară cu forța de ce energia
potențială ca funcție de distanța
intra moleculară va avea și ia
un minim și apoi va tinde către
0 minimul se află la aceeași poziție
0 și îl notăm acest minim cu e
pe 0 Deci e pe 0 este dacă vreți
adâncime aceste gropi faptul că
există o asemenea groapă de potențial
adică energia potențială are această
regiune pe care o înconjoară acum
este foarte semnificativ pentru
că se demonstrează că prezența
unei anumite gropi de potențial
ca aceasta duce la stări legate
asta înseamnă că dacă energia cinetică
a moleculelor este comparabilă
cu mărimea acestei gropi adică
cu e pe 0 atunci moleculele care
se află la distanțe compara 0 nu
mai sunt libere libere ce sunt
legate între ele prin forțe de
aceste forțe de interacție Deci
o groapă de potențial cu anumită
adâncime va duce la stări legate
pentru un recul se se află la distanțe
comparabile cu acest aceasta ne
permitem să devenim mult mai cantitativi
în descrierea noastră a stărilor
de agregare și să putem spune că
dacă energia cinetică a medie a
unei molecule care după cum am
văzut este habite împărțit la 2
dacă această energie cinetică medie
este mult mai mare decât energia
potențială decât minimul energiei
potențiale Dică de mărimea acestei
gropi de potențial atunci mișcarea
cinetică sau agitația termică domină
interacție din sistem moleculele
devin libere lasi lupi din aceste
legături potențiale devin libere
și atunci avem de a face cu un
gaz nici un gaz este dacă vreți
un sistem termodinamic în care
energia cinetică dată de agitația
termică domină interactive date
de Forțele de interacțiune dintre
molecule dacă în această energie
potențială groapa de potențial
adâncime a este comparabilă cu
energia cinetică medie atunci avem
o dacă vreți o luptă pe picior
de egalitate între cele două tipuri
de fenomene obținând lichid lichidul
este substanța în care moleculele
încă se pot mișca pentru că au
suficientă energie cinetică t cu
interacția de cu forța de atracție
dintre ele Deci se pot mișca dar
o pot face numai condiționat sau
constructional mișcarea lor nu
este liberă ca în cazul gazul și
ultimul caz este în care bineînțeles
energia potențială groapa adâncimea
acestei inițiale dintre Roxy este
mult mai mare decât energia cinetică
medie care vine din agitația termică
caz în care avem astfel de stările
moleculele nu se mai mișcă decât
eventual au mișcări de vibrație
dar nu mai au mișcări de translație
iar acesta este după cum știm un
solid intru stare solidă în moleculele
sau atomi se află în poziții fixe
în care ventral pat fibra în jurul
acelor poziții dar nu mai există
mișcare liberă