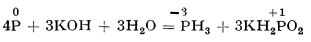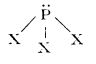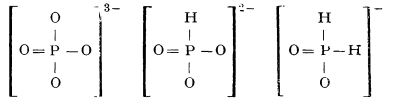Fosforul, P, este un element nemetalic din grupa 15 (V A) a tabelului periodic; are numărul atomic 15 și masa atomică 30,9738. Fosforul nu se găsește în stare liberă în natură, însă este destul de răspândit sub formă de compuși, în special fosfați de calciu. Fosforul are mai multe stări alotropice: fosforul alb, fosforul roșu și fosforul negru. Fosforul este un element esențial pentru organismele vii - este un important element constituent al țesuturilor (în special al oaselor și dinților), fiind necesar în formarea acizilor nucleici și a moleculelor transportatoare de energie (de exemplu ATP); de asemenea, este implicat în diverse reacții metabolice.
Fosforul nu se găsește în stare liberă în natură; în schimb este destul de răspândit sub formă de compuși, mai ales ca fosfați de calciu. După originea și structura lor, zăcămintele de fosfați de calciu se împart în apatite și fosforite.
Apatitele sunt roci eruptive de origine vulcanică, mineralul de bază fiind fluorapatitul, Ca
5[F(PO
4)
3]; zacaminte de apatit se găsesc în peninsula Kola, în Finlanda, Suedia, Spania, Africa de Sud.
Fosforitele sunt formațiuni sedimentare de diferite tipuri.
Fosforitele carstice sunt formate în golurile din roci calcaroase, prin acțiunea apelor subterane. Zăcăminte de acest tip se găsesc în Belgia, Franța, SUA etc.
Fosforitele stratificate cuprind diferite tipuri de zăcăminte de origine maritimă; ele se găsesc în Maroc, SUA, Rusia, Vietnam etc.
Fosforitele insulare sunt formate din excremente de păsări pe insule cu climat uscat, ca de exemplu pe unele insule din Oceanul Pacific. La noi în țară există fosforite de peșteră rezultate din excremente de lilieci (ca de exemplu la Cioclovina).
Fosforul se găsește combinat și în corpul plantelor și al animalelor sub formă de combinații anorganice, de exemplu în carapacea racilor și a scoicilor, în oasele vertebratelor, și sub formă de compuși organici, de exemplu în sânge, în păr, în gălbenușul de ou, în lapte, în fibre musculare, în celulele nervilor și ale creierului.
Prepararea fosforului se bazează pe reducerea pentaoxidului de fosfor cu cărbune, la temperatură înaltă:
2P2O5 + 10C → 10CO + P4
În industrie, fosforul se prepară din fosfat tricalcic, provenit fie din făina de oase, fie din fosforite și apatite.
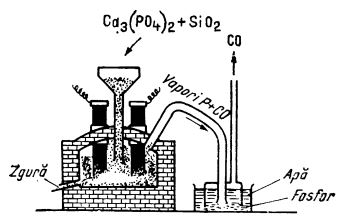
Fosfatul de calciu în amestec cu cărbune și nisip fin pulverizat se încălzește într-un cuptor electric (figura de mai jos), la o temperatură de peste 1300°C.
Cuptor electric pentru prepararea fosforului
Se formează silicat de calciu, CaSiO3, și anhidrida fosforică, P4O10, care este redusă de cărbune la P4:
2Ca3(PO4)2 + 6SiO2 + 10C → 6CaSiO3 + P4 + 10CO; 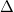 H = 730,7 kcal
H = 730,7 kcal
La temperatura înaltă din cuptorul electric, silicatul de calciu se topește formând o zgură (care se îndepărtează din cuptor pe măsura formării ei), în timp ce fosforul trece în stare de vapori. Vaporii de fosfor distilați se condensează în vase cu apă. Astfel obținut, fosforul este impus. După purificare este turnat în forme de bastonașe și păstrat sub apă.
Dacă o parte din nisip este înlocuit cu alumină, se obține, final, ca zgură, un silicat alumino-calcic, care poate fi utilizat drept ciment.
Fosforul apare în diferite modificații alotropice.
Fosforul alb. Fosforul alb se prezintă ca o masă albă-gălbuie, moale ca ceara, înct se poate tăia cu cuțitul. Densitatea lui este 1,82. Fosforul alb se topește la 44,1°C și fierbe la 280°C. Presiunea lui de vapori la temperatura obișnuită este mare. Fosforul are un miros neplăcut, care se apropie de cel al usturoiului.
Fosforul este insolubil în apă; se dizolvă, însă, foarte bine în sulfură de carbon, eter, benzen, ulei de terebentină etc. Evaporând cu încetul această soluție, fosforul cristalizează.
La fosforul alb se deosebesc două modificații cristaline. Fosforul obișnuit (fosfor alb - ɑ) este alcătuit din cristale cubice (densitate 1,82), care nu conduc curentul electric și se dizolvă ușor în dizolvanți organici, mai ales în sulfură de carbon. A doua varietate (fosfor alb - ꞵ) rezultă din forma ɑ la -77°C și este alcătuită din cristale hexagonale (cu densitatea 2,70). Proprietățile celor două forme cristaline sunt similare.
Molecula stabilă de fosfor este formată din patru atomi.
În moleculele P4, cei patru atomi de fosfor ocupă pozițiile vârfurilor unui tetraedru (figura de mai jos), unghiurile de valență fiind de 60°.
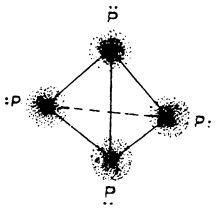 Structura tetraedrică a moleculei de P4
Structura tetraedrică a moleculei de P4
Abia la temperaturi de peste 800°C începe disocierea moleculelor P4 în molecule P2, dar numai treptat, astfel încât la 1700°C moleculele P4 și P2 sunt în număr egal. În soluție, fosforul este prezent de asemenea sub formă de molecule P4.
Fosforul alb este foarte reactiv; îndeosebi cu oxigenul se combină ușor. Astfel, dacă se încălzește o bucată de fosfor la circa 50°C, el se aprinde și arde cu o flacără gălbuie, formând pentoxid de fosfor:
P4 + 5O2 → 2P2O5; 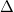 H = -370 kcal/mol P2O5
H = -370 kcal/mol P2O5
Aprinderea fosforului în aer este cu atât mai rapidă, cu cât el se găsește într-o stare mai fin divizată. De aceea, o hârtie de filtru înmuiată într-o soluție de fosfor în sulfură de carbon se aprinde spontan de îndată ce sulfura de carbon se evaporă. Sulfura de carbon, evaporându-se repede, lasă în porii hârtiei fosforul în stare de diviziune foarte fină; suprafața de contact a fosforului cu oxigenul din aer fiind mai mare, aprinderea are loc mai repede.
Din cauza aprinderii spontane a fosforului în aer, el trebuie păstrat sub apă.
În oxigen, fosforul se aprinde imediat și arde cu strălucire; arderea poate continua și sub apă.
Caracteristic pentru fosforul alb este lumina pe care o emană când este în prezență de vapori de apă și oxigen, la o temperatură inferioară temperaturii lui de aprindere. Acest fenomen se numește chimioluminiscență (sau fosforescență). El se datorează energiei reacției de oxidare a fosforului, care în acest caz se manifestă sub formă de lumină.
Chimioluminiscența este produsă de vapori de fosfor. De aceea, când se ține la întuneric un pahar cu puțină apă în care se găsesc bucăți de fosfor, în jurul lor se observă luminiscența caracteristică fosforului. Tot așa, dacă într-un pahar se introduce o bucățică de fosfor umed și se umple paharul cu dioxid de carbon, la încălzire se poate vedea la întuneric cum la gura paharului, unde vaporii de fosfor sunt în contact cu aerul, iese o flacără verzuie fosforescentă.
Fosforul nu prezintă fenomenul de chimioluminiscență când este în contact cu oxigen pur la presiune obișnuită; când presiunea oxigenului scade, luminiscența apare din nou. Alcoolul, eterul, sulfura de carbon, clorul, amoniacul etc. slăbesc chimioluminiscența fosforului.
Fenomenul de luminiscență a fost atribuit mecanismului înlănțuit al reacției de oxidare lentă a fosforului (N. Semenov, 1927).
Pentru ca aceasta să se poată desfășura în aer, oxigenul trebuie să aibă o anumită presiune parțială (limita superioară fiind aproape de 700 mm Hg). Alcoolul, eterul, sulfura de carbon, etc au rol de inhibitori ai reacției înlănțuite.
Fosforul se aprinde spontan și arde în curent de clor; rezultă pentaclorura de fosfor:
P4 + 10Cl2 → 4PCl5
Cu hidrogenul, fosforul se combină în mod indirect, trecând în hidrogen fosforat, PH3. La temperaturi înalte, reacționează cu metalele, formând fosfuri.
Din cauza reactivității lui față de oxigen, fosforul este un reducător puternic. Astfel, acidul azotic concentrat îl transformă în acid fosforic, reacție care este foarte energică.
Cu hidroxizii alcalini se combină cu formare de fosfină și hipofosfit alcalin. Este un proces în care fosforul este concomitent redus și oxidat:
Fosforul alb este foarte otrăvitor; în cantitate de numai 0,1 g omoară un om. Introdus în stomac produce vărsături cu dureri mari și moarte.
Fosforul roșu. Fosforul alb, păstrat într-un vas de sticlă transparentă și incoloră capătă cu timpul o culoare roșie deschisă; el trece într-o modificație alotropică, fosforul roșu. Această transformare a fosforului alb se produce cu încetul și numai la suprafață, sub acțiunea luminii; sub acțiunea căldurii, transformarea are loc mult mai repede și aproape în întregime. De aceea, dacă se încălzește fosfor topit la 240-250°C, în absență de aer (preferabil în prezența luminii sau a unui catalizator, cum este iodul sau sodiul) rezultă fosfor roșu.
Fosforul roșu se deosebește de fosforul alb prin reactivitate chimică mai mică, insolubilitate în unii dizolvanți organici, cum este sulfura de carbon, și caracterul netoxic.
Culoarea, presiunea de vapori, punctul de topire și alte caracteristici ale fosforului roșu depind de temperatura și durata încălzirii în timpul preparării. Astfel, culoarea variază de la roșu la violet, presiunea de vapori devine constantă numai dacă încălzirea s-a făcut un timp peste 550°C. Aceste constatări au dus la concluzia că fosforul roșu este în realitate modificația violetă a fosforului, impurificată cu fosforul stacojiu. Fosforul violet are o structură cristalină romboedrică, iar fosforul stacojiu este amorf.
Fosforul roșu sublimează la 416°C la presiune atmosferică. El se topește la 589,5°C, când presiunea lui de vapori este 43,1 atm. Lichidul este incolor, ca și cel rezultat la topirea fosforului alb.
La temperatura obișnuită, fosforul roșu nu are miros și nu manifestă fenomenul de luminiscență. Este însă oxidat de acidul azotic la acid fosforic.
Fosforul negru. Se mai cunoaște și altă modificație alotropică a fosforului. Astfel, supus unei presiuni foarte înalte (12000 atm) și încălzit la 200°C, fosforul alb trece în
fosfor negru. În comportare, acesta se aseamănă cu fosforul roșu; este dur, casant și insolubil în sulfură de carbon, dar este mai reactiv și conduce curentul electric. Structura lui este asemănătoare grafitului.
Proprietățile modificațiilor alotropice colorate ale fosforului se datorează structurii lor macromoleculare.
Fosforul alb fiind otrăvitor are puține întrebuințări; în cantități reduse este folosit la prepararea unor antidăunători (șobolani și șoareci). În metalurgie este utilizat pentru prepararea unor aliaje de fier, cupru sau staniu. În timp de război fosforul a fost utilizat la fabricarea bombelor incendiare sau pentru umplerea proiectilelor de artilerie.
Fosforul roșu are aproape aceleași întrebuințări ca și fosforul alb; mari cantități sunt folosite la fabricarea chibriturilor.
Atomul de fosfor are cinci electroni pe stratul electronic exterior. De aceea, în combinațiile cu hidrogenul și metalele, fosforul are numărul de oxidare trei, pe când în combinațiile cu oxigenul, numărul lui de oxidare maxim este cinci.
Diferitele numere de oxidare pe care le poate manifesta fosforul în combinațiile sale sunt următoarele:
Numerele de oxidare pe care le manifestă fosforul în combinațiile sale
| Numărul de oxidare |
+5 |
+3 |
+1 |
0 |
-2 |
-3 |
| Exemple de combinații |
P2O5
H3PO4 |
P2O3
H3PO3 |
-
H3PO2 |
P4
- |
P2H4
- |
PH3
- |
Fosforul este mai puțin electronegativ decât azotul.
Fosforul formează cu hidrogenul două combinații: fosfina, PH3, și difosfina, P2H4.
Compușii binari ai fosforului cu halogenii sunt de obicei tri- și penta- halogenuri (tetrahalogenurile sunt mai puțin cunoscute).
Trihalogenurile de fosfor, PX
3, se obțin prin reacția directă între fosfor și halogeni în condiții controlate, pentru a nu se forma alte halogenuri. Trihalogenurile au structură de piramidă cu atomul de fosfor în vârf:
Datorită perechii de electroni neparticipanți ai atomului de fosfor, trihalogenurile au caracter nesaturat. Ele reacționează cu halogenii formând pentahalogenuri, PX5; cu oxigenul formează oxihalogenuri, POX3.
Dintre trihalogenuri cea mai importantă este triclorura de fosfor, PCl3.
Pentahalogenurile de fosfor, PX
5, sunt mai puțin stabile decât trihalogenurile respective, cea mai stabilă fiind pentafluorura de fosfor, PF
5; pentaiodura nu se cunoaște. Pentaclorura de fosfor, PCl
5, este o halogenură importantă a fosforului.
Fosforul formează oxizi cu compoziția moleculară:
- P4O6 - trioxid de fosfor;
- P4O10 - pentoxid de fosfor;
- (PO2)n - tetroxid de fosfor;
- PO3 sau P2O6 - care este un peroxid de fosfor.
Oxizii P4O6 și P4O10 sunt anhidridele acizilor fosforos, H3PO3, și fosforic, H3PO4.
Fosforul formează mai mulți oxoacizi (de la care derivă o serie de fosfați):
Oxoacizii fosforului și fosfații derivați
| Oxoacizi |
Fosfați |
| H3PO2 - acid hipofosforos |
MIPO2H2 - hipofosfit |
| HPO2 - acid metafosforos |
MIPO2 - metafosfit |
| H4P2O5 - acid pirofosforos |
M2IP2O5H2 - pirofosfit |
| H3PO3 - acid ortofosforos (fosforos) |
M2IPO3H - ortofosfit |
| H4P2O6 - acid hipofosforic |
M4IP2O6 - hipofosfat |
| HPO3 - acid metafosforic |
MIPO3 - metafosfat |
| H5P3O10 - acid trifosforic (tripolifosforic) |
M5IP3O10 - tripolifosfat |
| H4P2O7 - acid pirofosforic |
M4IP2O7 - pirofosfat |
| H3PO4 - acid ortofosforic |
M3IPO4 - ortofosfat |
| H3PO5 - acid peroxomonofosforic |
M3IPO5 - peroxomonofosfat |
| H4P2O8 - acid peroxodifosforic |
M4IP2O8 - peroxodifosfat |
Pentoxidului de fosfor, P4O10, îi corespunde acidul fosforic (ortofosforic) H3PO4. De la acesta, prin eliminare parțială de molecule de apă între două molecule de acid (condensare) derivă mai mulți acizi condensați, dintre care cei mai importanți sunt acidul pirofosforic, H4P2O7, și acizii metafosforici, (HPO3)n, unde n = 3, 4, 5, 6: Ei derivă de la fosforul cu numărul de oxidare +5.
Trioxidului de fosfor, P4O6, îi corespunde acidul fosforos, H3PO3, de la care derivă ca acizi condensați: acidul pirofosforos, H4P2O5, și acidul metafosforos, HPO2. În acești compuși, fosforul are numărul de oxidare +3.
Un număr intermediar de oxidare (+4) prezintă fosforul în acidul hipofosforic, H4P2O6; acesta poate fi considerat rezultat prin condensarea unei molecule de acid fosforic cu o moleculă de acid fosforos:
H3PO4 + H3PO3 → H4P2O6 + H2O
Aceasta nu este însă o metodă de obținere a acestui acid.
De la acidul fosforic mai derivă și doi peroxoacizi: acidul peroxomonofosforic, H3PO5, și acidul peroxodifosforic, H4P2O8, rezultați prin înlocuirea unei grupe — OH din acidul pirofosforic, cu o grupă — O — OH (peroxo).
În acizii oxigenați, fosforul are numărul de coordinație patru. Toți oxoacizii fosforului au legături P — OH în care atomul de hidrogen este ionizabil; atomii de hidrogen în legături P — H nu sunt ionizați. Așa se poate explica de ce acidul fosforos, care conține un atom de hidrogen legat de atomul de fosfor, ca și atomii de oxigen, este un acid dibazic, deși conține trei atomi de hidrogen în moleculă, iar acidul hipofosforos, care conține doi atomi de hidrogen legați de atomul de fosfor, este un acid monobazic, deși conține trei atomi de hidrogen în moleculă:
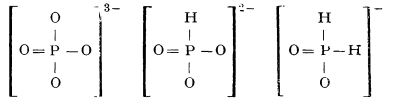 ion fosfat ion fosfit ion hipofosfit
ion fosfat ion fosfit ion hipofosfit
Acizii fosforici condensați fiind rezultați prin eliminarea unei molecule de apă între două grupe OH, conțin doi atomi de fosfor uniți printr-un atom de oxigen.
Dintre oxoacizii fosforului se menționează acidul fosforos și, îndeosebi, acidul fosforic.
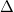 H = 730,7 kcal
H = 730,7 kcal
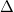 H = -370 kcal/mol P2O5
H = -370 kcal/mol P2O5