Grupa a III-a principală a sistemului periodic cuprinde elementele bor, B, și aluminiu, Al, foarte răspândite în natură, și trei elemente rare: galiul, Ga, indiul, In, și taliul, Tl.
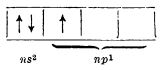
Atomii acestor elemente au în stratul electronic exterior trei electroni de valență, ns2np1:
Datorită celor trei electroni de valență din stratul electronic exterior, numărul de oxidare maxim al elementelor grupei 13 este trei; acesta se manifestă mai ales în combinațiile halogenate și în cele oxigenate.
Borul și aluminiul formează numai un număr redus de combinații în care manifestă numere inferioare de oxidare, pe când galiul, indiul și taliul pot fi trecuți ușor în stări de oxidare inferioare; taliul, în combinațiile sale, are mai mult gradul de oxidare +1 decât +3.
Aceasta se datorează faptului că borul și aluminiul folosesc simultan cei trei electroni (s2p1) la formarea legăturilor; când atomul se găsește în stare excitată, un electron din nivelul, un electron din nivelul s trece pe nivelul p, așa încât rezultă trei orbitali hibrizi s1p2. Elementele galiu, indiu și taliu prezintă două numere de oxidare: când participă numai electronul p și când intervin și cei doi electroni s (hibridizarea se face însă mai greu decât în cazul borului și aluminiului).
Borul nu formează ioni, iar aluminiul numai în puține cazuri. Celelalte elemente din grupă pot ioniza formând cationi trivalenți, X3+:
X - 3e- = X3+
Galiul și indiul pot forma și cationi monovalenți, X+; combinațiile corespunzătoare sunt însă nestabile.
Borul formează numai covalențe; de asemenea, și celelalte elemente ale grupei formează covalențe.
În afară de covalența obișnuită, trei, a grupei, manifestată de atomul în stare excitată, adică având hibridizarea s1p2, elementele grupei pot forma și legături coordinative, în care atomii lor au rol de acceptori. Valența lor de coordinație obișnuită este patru; aluminiul poate manifesta și numărul de coordinație șase.
Proprietățile fizice ale elementelor grupei sunt indicate în tabelul de mai jos. Se observă că galiul, indiul și taliul se deosebesc mult de aluminiu și, mai ales, de bor, în ceea ce privește punctele de topire și densitatea.
Caracteristicile elementelor din grupa 13 a tabelului periodic
| Numele și simbolul elementului |
Bor
B |
Aluminiu
Al |
Galiu
Ga |
Indiu
In |
Taliu
Tl |
| Numărul atomic |
5 |
13 |
31 |
49 |
81 |
| Configurația electronică exterioară |
2s22p1 |
3s23p1 |
4s24p1 |
5s25p1 |
6s26p1 |
| Masa atomică |
10,81 |
26,98 |
69,72 |
114,82 |
204,37 |
| Densitatea, g/cm3 (s) |
2,34 |
2,70 |
5,91 |
7,31 |
11,85 |
|
Punctul de topire, °C
|
2076 |
660,3 |
29,76 |
156,6 |
303,5 |
| Punctul de fierbere, °C |
2470 |
3927 |
2400 |
2072 |
1473 |
| Potențialul de ionizare, eV |
8,29 |
5,98 |
6,00 |
5,78 |
6,10 |
| Electronegativitatea (Pauling) |
2,0 |
1,5 |
1,6 |
1,7 |
1,8 |
| Raza de covalență, Å |
0,82 |
1,18 |
1,26 |
1,44 |
1,48 |
| Raza ionică în cristal (pt. X3+), Å |
0,20
(valoare teoretică) |
0,57 |
0,65 |
0,95 |
0,95 |
Punctul de topire foarte ridicat la bor indică o legătură puternică între atomii lui în stare solidă. Rețelele metalice ale celorlalte elemente se pot rupe cu mai multă ușurință și punctele lor de topire sunt deci mai scăzute. Punctele de fierbere ale elementelor grupei sunt ridicate și, în general, descresc cu creșterea masei atomice. Cu excepția borului, celelalte elemente se remarcă prin domeniul larg între punctul de topire și punctul de fierbere, proprietate deosebit de pronunțată la galiu.
Dintre elementele grupei a III-a principală, numai borul are caracter nemetalic, dar destul de atenuat; toate celelalte elemente au caracter metalic. Accentuarea caracterului electropozitiv al elementelor din grupă nu se face însă în mod atât de regulat ca la elementele grupelor I și a II-a principale, și anume de la bor la aluminiu caracterul electropozitiv crește, iar de la aluminiu la galiu și apoi la indiu și taliu, el scade.
Cauza este că, în timp ce de la beriliu la bor și de la magneziu la aluminiu sarcina nucleară crește cu o unitate, de la calciu la galiu ea crește cu 11 unități (deoarece se intercalează elementele de tranziție, la care se completează orbitalii d). Aceasta duce la o legare mai puternică a electronilor de valență, deci la o slăbire a caracterului electropozitiv. Situația este similară pentru indiu și taliu.
Cu oxigenul, elementele grupei a III-a principale formează oxizi de tipul X2O3. Comportarea acestor oxizi variază de la bor la taliu. Astfel, oxidul de bor este o anhidridă acidă. Oxidul de aluminiu se comportă ca anhidridă acidă numai față de baze tare; de obicei se manifestă ca oxid bazic. Oxizii de galiu și de indiu sunt amfoteri cu caracter bazic predominant. Oxidul de taliu (III) este greu solubil, așa încât caracterul amfoter este mai slab; în schimb oxidul de taliu (I) are caracter puternic bazic.
Cu hidrogenul, elementele grupei 13 formează hidruri. Acestea apar în stare liberă numai sub formă asociată, de exemplu (BH3)2, (AlH3)2. Legătura între molecule se face prin punți de hidrogen.
Cu excepția borului, elementele grupei a III-a principale pot forma săruri în care au rol de component electropozitiv. De asemenea formează săruri duble. Astfel, aluminiul, galiul și indiul formează sulfați dubli (alauni) MIMIII(SO4)2·12H2O; taliul formează sulfați dubli de tipul MIMIII(SO4)2·4H2O.
Dintre elementele grupei a III-a principale a sistemului periodic foarte importante sunt borul și aluminiul.