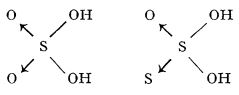Grupa a VI-a principală a sistemului periodic (sau grupa 16) cuprinde elementele
, Po. Elementele grupei 16 se mai numesc și
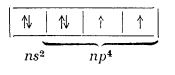
Atomii acestor elemente au stratul electronic exterior format din șase electroni:
De aceea, atomii acestor elemente pot accepta doi electroni și iau configurația electronică a gazului rar cel mai apropiat în tabelul periodic.
Formarea legăturilor în combinațiile calcogenilor
Elementele grupei 16 pot forma combinații ionice cu elemente puternic electropozitive în care sunt întotdeauna bivalent negative, iar în soluții pot avea rol de anion:
X0 + 2e- → X-
Atomii elementelor grupei 16 (VI A) își pot completa octetul lor electronic și prin formarea a două legături covalente; de exemplu, în combinațiile cu hidrogenul: H2O, H2S, etc.
La formarea acestor covalențe intervin cei doi electroni p necuplați din stratul electronic exterior.
Cu excepția oxigenului, atomii elementelor grupei a VI-a principale pot avea și numere superioare de oxidare, manifestând drept covalență maximă, valența șase (corespunzător numărului grupei).
Comportarea deosebită a oxigenului este datorită faptului că electronii lui sunt legați foarte puternic (ceea ce se explică prin sarcina nucleară efectivă foarte mare față de o rază atomică relativ mică). Din cauza potențialului de ionizare foarte mare a oxigenului, nici un atom de alt element nu poate să-i smulgă electroni din învelișul exterior. Ca urmare, în combinații, oxigenul constituie totdeauna componentul negativ.
Nici în combinații covalente, oxigenul nu poate manifesta grade de oxidare mai mari decât doi, întrucât stratul electronic cu număr cuantic n = 2, în care se găsesc cei șase electroni exteriori, nu cuprinde decât patru orbitali, care pot fi ocupați de opt electroni, ceea ce se realizează prin formarea a două covalențe. La omologii oxigenului însă, stratul în care se găsesc electronii exteriori, având un număr cuantic mai mare de n = 2, cuprinde și orbitali d. Dar, pentru ca omologii oxigenului să manifeste mai mult de două covalențe, trebuie ca o parte din electronii structurii stratului exterior să fie promovați în orbitali d din același strat. De aceea combinațiile în care elementele manifestă covalențe superioare derivă de la stări activate ale atomilor și nu de la stările fundamentale.
Atomii de sulf, seleniu, telur pot forma și combinații în care sunt legați coordinativ, având rol de donori de electroni.
Perechile de electroni neparticipanți care pot forma legături coordinative sunt perechea de electroni p și perechea de electroni s din stratul electronic exterior (uneori, și electronii d).
Datorită faptului că în stratul electronic exterior au șase electroni, atomii elementelor grupei a VI-a principale pot avea rol și de acceptori de electroni. Această proprietate se manifestă mai ales la oxigen, care formează un număr mare de oxoacizi. Sulful poate înlocui oxigenul în mulți din acești oxoacizi, formând tioacizi, în care are, de asemenea, rol de acceptor de electroni. Se pot da ca exemplu acidul sulfuric și acidul tiosulfuric:
Proprietățile fizice ale elementelor grupei a VI-a principale sunt arătate în tabelul de mai jos.
Caracteristicile elementelor din grupa 16 a sistemului periodic
| Caracteristici |
Oxigen
O |
Sulf
S |
Seleniu
Se |
Telur
Te |
| Numărul atomic |
8 |
16 |
34 |
52 |
| Configurația electronică exterioară |
2s22p4 |
3s23p4 |
4s24p4 |
5s25p4 |
| Masa atomică |
15,999 |
32,064 |
78,96 |
127,60 |
| Densitatea, (s) g/cm3 |
1,27 |
2,06 |
4,82 |
6,25 |
| Punctul de topire, °C |
-218,9 |
118,95 |
220,2 |
452,0 |
| Punctul de fierbere, °C |
-182,9 |
444,60 |
688 |
1390 |
| Potențialul de ionizare, eV |
13,614 |
10,367 |
9,750 |
9,01 |
| Afinitatea pentru electron, eV |
-7,28 |
-3,44 |
-4,21 |
- |
| Electronegativitatea (conform L. Pauling) |
3,5 |
2,5 |
2,4 |
2,1 |
| Raza de covalență, Å |
0,74 |
1,04 |
1,17 |
1,37 |
| Raza ionică (pt. X2-), Å |
1,40 |
1,84 |
1,98 |
2,21 |
Molecula oxigenului este biatomică, pe când celelalte elemente au molecule biatomice numai la temperaturi destul de înalte (când sunt în stare de vapori). În stare solidă, moleculele acestor elemente pot cuprinde până la 8 atomi.
Toate elementele există în mai multe modificații alotropice.
Prin faptul că atomii acestor elemente pot accepta electroni, ei au caracter electronegativ. Cu creșterea numărului atomic, acest caracter slăbește. Cel mai puternic se manifestă caracterul electronegativ la oxigen și la sulf; seleniul și telurul fac trecerea spre metale. Astfel, seleniul, pe lângă modificația alotropică obișnuită, are și una metalică, iar modificația alotropică obișnuită a telurului este cea metalică; de asemenea pot forma unele săruri în care au rol de component electropozitiv (de exemplu TeSO4). Poloniul, ultimul element din grupă, are caracter metalic mai pronunțat (în soluție apoasă poate apare sub formă de ioni pozitivi).
Cu hidrogenul, elementele grupei 16 formează combinații de tipul H2X, în care manifestă covalența normală a grupei. Pe când apa este neutră, hidrurile celorlalte elemente sunt însă acizi slabi.
Intensificarea caracterului acid al combinațiilor H2X se datorează, după teoria lui Kossel, creșterii razei ionului negativ; protonul se desprinde cu atât mai ușor cu cât raza ionică este mai mare (deci ecranarea datorită straturilor electronice este mai mare).
Cu oxigenul, elementele acestei grupe formează oxizi de tipul XO2 și XO3. Acești oxizi sunt anhidride acide.