Grupa 18 (VIII A)
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Elementele grupei
Grupa a VIII-a principală a sistemului periodic, numerotată VIII A sau 18, numită și grupa gazelor rare sau nobile, cuprinde elementele heliu, He, neon, Ne, argon, Ar, kripton, Kr, xenon, Xe și radon, Rn.
(Numele gazelor rare derivă din limba greacă, și anume: heliul de la "helios" = soare; neonul de la "neon" = nou; kriptonul de la "kriptos" = ascuns; xenonul de la "xenon" = străin.)
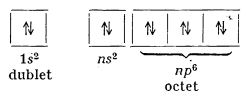
Atomii acestor elemente au învelișul electronic exterior caracterizat la heliu prin doi electroni, dublet (1s2), iar la atomii celorlalte elemente prin opt electroni, octet (ns2np6):
Răspândirea în natură
Sursa cea mai abundentă de gaze rare o reprezintă aerul atmosferic, care le conține în proporție de aproximativ 1%.
Radonul, a cărui prezență este legată de aceea a radioelementelor care îl produc prin dezintegrare radioactivă, se găsește în atmosferă numai ca urme variabile (de ordinul 6 • 10-18% vol.).
Gazele rare mai sunt răspândite în unele izvoare de ape termale, gaze vulcanice, în gazele grizu și petroliere, în gaze incluse în minereuri și roci, în apa de ploaie, în apa de mare, etc.
Astfel, heliul, care rezultă din transformări radioactive, se găsește întotdeauna în ape și minerale radioactive (care pot conține până la 10 ml heliu pe gram de mineral). Heliul a mai fost identificat în cromosfera soarelui, precum și în unele stele și nebuloase calde.
Obținere
Heliul se poate obține din gaze naturale, prin fracționare la temperatură joasă. În cantități mai mici se extrage prin încălzire la 1000-1200°C a unor minerale (de exemplu cleveit, monazit, torianit).
Argonul, ca și celelalte gaze rare, cu excepția radonului, se obțin din aer lichefiat, prin repetate distilări fracționate (procedeul G. Claude) sau prin adsorbție fracționată pe cărbune activ.
Proprietăți fizice
Elementele grupei sunt incolore, cu excepția radonului care, fiind radioactiv, este și luminiscent. Densitatea, punctul de fierbere și punctul de topire cresc în grupă odată cu numărul atomic, după cum se vede și în tabelul de mai jos.
| Caracteristici | Heliu He |
Neon Ne |
Argon Ar |
Kripton Kr |
Xenon Xe |
Radon Rn |
|---|---|---|---|---|---|---|
| Numărul atomic/ de ordine | 2 | 10 | 18 | 36 | 54 | 86 |
| Masa atomică | 4,0026 | 20,183 | 39,948 | 83,80 | 131,30 | (222) |
| Densitatea, g/L | 0,178 | 0,899 | 1,786 | 3,736 | 5,891 | 9,96 |
| Punctul de topire, °C | -272,1 (la 25 atm) |
-248,6 | -189,4 | -156,6 | -111,5 | -71 |
| Punctul de fierbere, °C | -269,0 | -246,0 | -185,8 | -152,9 | -107,1 | -65 |
| Solubilitatea în apă, mL/L, la 20°C |
13,8 | 14,7 | 37,9 | 73 | 110,9 | - |
| Raza atomică, Å | 1,29 | 1,60 | 1,92 | 1,98 | 2,18 | - |
| Potențialul de ionizare (pentru primul electron), eV |
24,58 | 21,56 | 15,76 | 14,00 | 12,13 | 10,75 |
Heliul este cel mai ușor dintre toate gazele, după hidrogen; heliul are punctul de fierbere și de solidificare foarte aproape de zero absolut.
Gazele rare sunt sunt relativ puțin solubile în apă; solubilitatea lor crește odată cu creșterea masei atomice a elementului.
Cu excepția heliului, gazele rare pot fi adsorbite de către cărbunele activ la temperaturi joase. Dintre gazele rare, heliul poate difuza la temperaturi înalte prin sticla de cuarț (proprietate folosită la separarea heliului de neon).
Spre deosebire de alte substanțe gazoase, gazele rare sunt monoatomice la temperatură obișnuită; deci, masele lor moleculare sunt identice cu masele lor atomice. Din cauza monoatomicității, spectrele gazelor rare sunt formate din linii și nu din benzi. Aceste linii, foarte strălucitoare, se găsesc mai ales în partea vizibilă a spectrului. Pe spectrele caracteristice ale gazelor rare se bazează de altfel identificarea lor.
Gazele rare opun rezistență slabă trecerii curentului electric; tuburi de sticlă prevăzute cu electrozi și umplute cu gaze rare sub presiune joasă emit, sub tensiune electrică, lumini colorate: galbenă în cazul heliului, roșie-stacojie în cazul neonului, roșie la argon, verde-violetă la kripton, violetă la xenon și albă strălucitoare la radon.
Argonul, kriptonul și xenonul formează cu apa, la temperaturi joase și presiuni înalte, produse de adiție (de exemplu hidratul Kr • 5,7H2O). Acești hidrați cristalini se descompun imediat la încălzire sau la micșorarea presiunii. Studii structurale au arătat că în hidrați, gazele rare sunt incluse în spațiile interstițiale formate de moleculele de apă asociate între ele prin legături de hidrogen, adică formează clatrați (un clatrat este un compus molecular solid, un agregat, în care moleculele unuia din componente se găsesc incluse în rețeaua cristalină a celuilalt component, ca într-o cușcă; în lb. latină, clathratus = închis, sau protejat sub gratii). La formarea clatraților, electronii de valență ai gazelor rare nu sunt implicați în legături chimice; octetul electronic rămâne nesolicitat.
Proprietăți chimice
Cu toate concepțiilor de până acum asupra inactivității chimice a gazelor rare, în decursul anilor s-au făcut totuși diferite încercări de a le combina cu alte substanțe, dar fără rezultate pozitive. Gazele nobile sunt nereactive în termeni relativi, însă unele (în special xenonul) nu sunt deloc "inerte" chiar dacă această etichetă a fost aplicată la un moment dat. Aceste gaze au potențiale de ionizare ridicate, dar, cu excepția heliului și neonului, nu atât de ridicate încât reacțiile chimice să fie imposibile. Ipoteza invulnerabilității gazelor "inerte" a fost însă spulberată prin lucrările lui Neil Bartlett și D. H. Lohmann care în 1962 au reușit să obțină primul compus chimic al unui gaz nobil (xenon) și anume - hexafluoroplatinatul de xenon, Xe[PtF6].
La desfășurarea reacției s-a ținut cont de faptul că oxigenul reacționează cu hexafluorura de platină, PtF6, care este un agent oxidant extrem de puternic:
O2(g) + PtF6(g) → O2+[PtF6-](s)
Unul dintre motivele pentru care această reacție este atât de interesantă este că potențialul de ionizare pentru molecula de oxigen este de 12,1268 eV (1170 kJ/mol) - prin comparație cu potențialul de ionizare pentru un atom de hidrogen care este de 13,5979 eV (1312 kJ/mol) - iar pentru xenon este de 12,1987 eV (1177 kJ/mol). Este evident că dacă PtF6 va elimina un electron din molecula de oxigen, ar trebui de asemenea să elimine un electron și din atomul de xenon. Când s-a încercat această reacție s-a obținut un solid galben-portocaliu și s-a considerat (parțial incorect, după cum s-a dovedit mai târziu) că produsul de reacție este Xe+[PtF6]-, hexafluoroplatinatul de xenon. S-a demonstrat mai târziu că produsul era, de fapt, XeF+[Pt2F11]-.
Întrebuințări
Aplicațiile gazelor rare s-au bazat până în prezent pe proprietățile fizice și pe așa numita inerție chimică a acestor elemente. Astfel, argonul și kriptonul sunt folosite în locul azotului pentru umplerea becurilor electrice; având conductibilitate termică mai mică decât azotul, lumina obținută în bec este mai albă.
Supuse la presiuni joase în tuburi de sticlă în care au loc descărcări electrice, gazele rare, fie singure, fie amestecate între ele sau cu vapori de mercur, dau lumini diferit colorate, folosite la reclamele luminoase. La iluminatul electric modern se folosesc tuburi de sticlă care au pe pereții interiori depuse sulfuri metalice cu proprietăți fluorescente. Asemenea tuburi sunt umplute cu argon și vapori de mercur și dau la descărcări electrice o lumină puternică albă.
Gazele rare sunt folosite și în cercetarea științifică. Astfel, argonul este utilizat în camere de ionizare pentru studiul radiațiilor X și al radiațiilor cosmice, precum și în contoare Geiger-Müller. Unele gaze rare, ca heliul și neonul, au început să fie folosite în tehnica laser.
Fiind neinflamabil și având densitate mică, heliul este întrebuințat pentru umplerea baloanelor de observație meteorologică.
În metalurgie, argonul și heliul sunt utilizate la sudura în arc electric a unor metale și aliaje speciale, ca de exemplu: aluminiu, magneziu, titan sau oțeluri inoxidabile pe bază de siliciu și aluminiu, precum și la tratamente termice în atmosferă protectoare, în special pentru recoacerea oțelurilor bogate în carbon.
Se prevăd, de asemenea, și pentru compușii gazelor rare apliacații practice. Astfel, fluorurile de xenon ar putea fi folosite ca agenți de fluorurare în locul fluorului, oxizii de xenon ca oxidanți puternici; de altfel, cu ajutorul trioxidului de xenon s-a reușit oxidarea Pu (III) la Pu (IV).
Preambul
Referințe
1. Edith Beral, Mihai Zapan: Chimie Anorganică, ediția a 3-a, Editura Tehnică, București, 1963
2. James E. House: Inorganic Chemistry, Academic Press, Elsevier, 2008, ISBN 9780123567864






