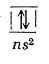Grupa a II-a principală a tabelului periodic cuprinde elementele: beriliu, Be, magneziu, Mg, calciu, Ca, stronțiu, Sr, bariu, Ba, precum și elementul radioactiv radiu, Ra. Această grupă se mai numește grupa metalelor alcalino-pământoase, după reprezentanții ei principali: calciul, stronțiul și bariul, care sunt numite metale alcalino-pământoase deoarece oxizii lor ocupă o poziție intermediară între oxizii metalelor alcaline și oxizii elementelor grupei 13, cu reprezentantul tipic aluminiul, element întâlnit în compoziția tuturor argilelor (pământurilor).
Atomii elementelor din grupa a II-a principală conțin doi electroni în învelișul electronic exterior, ns2:
Datorită celor doi electroni de valență din învelișul electronic exterior, numărul de oxidare al grupei este doi. Stratul electronic anterior este format din 8 electroni (cu excepția beriliului, la care acesta este format din doi electroni), strat de gaz rar, ceea ce explică de ce aceste elemente nu pot avea valențe superioare de doi.
Din cauza așezării lor în sistemul periodic în apropierea gazelor rare (de care îi desparte numai o grupă), elementele grupei a II-a principale au tendința dominantă să cedeze doi electroni ca să dobândească configurația acestor gaze:
X - 2e- = X2+
Formarea cationilor bivalenți este deci o caracteristică a acestor elemente (numai beriliul ionizează greu).
În stare normală, atomii elementelor grupei 2 (II A) nu posedă electroni necuplați, condiție esențială pentru formarea covalențelor. Pentru ca acestea să se formeze, trebuie ca în starea excitată a atomului, un electron s să fie ridicat pe un nivel p. Combinațiile de acest tip, de exemplu combinațiile cu radicali organici, sunt puțin stabile.
Elementele grupei 2 pot forma însă unele combinații complexe, tendința care slăbește și chiar dispare pe măsură ce crește masa atomică a elementelor. Astfel, beriliul, al cărui volum atomic este foarte mic, poate forma compuși care au caracter complex; de exemplu se cunosc ioni complecși BeX42-, unde X = F și Cl, în care beriliul are valența coordinativă.
Proprietățile fizice ale acestor elemente sunt redate în tabelul de mai jos:
Caracteristicile elementelor din grupa a II-a principală a sistemului periodic
| Caracteristici |
Beriliu
Be |
Magneziu
Mg |
Calciu
Ca |
Stronțiu
Sr |
Bariu
Ba |
Radiu
Ra |
| Numărul atomic |
4 |
12 |
20 |
38 |
56 |
88 |
| Configurația electronică exterioară |
2s2 |
3s2 |
4s2 |
5s2 |
6s2 |
7s2 |
| Masa atomică |
9,012 |
24,312 |
40,08 |
87,62 |
137,34 |
[226] |
| Densitatea (s), g/cm3 |
1,85 |
1,74 |
1,55 |
2,60 |
3,5 |
5,0 |
| Punctul de topire, °C |
1278 |
648,8 |
839 |
777 |
727 |
696 |
| Punctul de fierbere, °C |
2970 |
1090 |
1484 |
1382 |
1897 |
1737 |
Potențialul de ionizare, eV
(pentru primul e-) |
9,32 |
7,64 |
6,11 |
5,92 |
5,21 |
5,28 |
| Electronegativitatea (Pauling) |
1,5 |
1,2 |
1,0 |
1,0 |
0,9 |
- |
| Raza de covalență, Å |
0,86 |
1,20 |
1,39 |
1,49 |
1,52 |
- |
| Raza ionică, (pentru X2+), Å |
0,31 |
0,75 |
1,06 |
1,18 |
1,38 |
1,42 |
Beriliul, primul element al grupei, în comportare se aseamănă mai mult cu aluminiul, care se găsește în grupa 13, decât cu omologii săi din grupă, iar magneziul prezintă asemănări cu zincul, care se găsește în grupa 12. De abia de la al treilea element din grupă începe să se manifeste caracterul grupei.
Cu excepția radiului, toate celelalte elemente din grupă sunt metale ușoare. Deși din punct de vedere chimic radiul se aseamănă cu metalele alcalino-pământoase, totuși, din cauza proprietății sale caracteristice, radioactivitatea, el ocupă o poziție aparte în grupă.
Toate elementele din grupa a II-a principală, din cauza caracterului electropozitiv foarte puternic, sunt așezate la începutul seriei tensiunilor (după metalele alcaline). Astfel, toate elementele grupei descompun apa; la beriliu și magneziu, această reacție este lentă, deoarece hidroxizii rezultați din reacția cu apa:
Mg + 2H2O = Mg(OH)2 + H2
sunt greu solubili și protejează suprafața metalului de atac în adâncime. Metalele alcalino-pământoase propriu-zise reacționează mai ușor cu apa întrucât hidroxizii lor sunt mai solubili.
Și stabilitatea față de aer scade de la magneziu la bariu. De asemenea, aceste metale separă metalele grele din soluțiile sărurilor lor.
Cu oxigenul, metalele grupei a II-a principale formează oxizi cu compoziția MIIO.
Unele metale formează și peroxizi de tipul MIIO2; aceștia se obțin prin tratarea hidroxizilor metalelor metalelor din grupă cu apă oxigenată:
Ca(OH)2 + H2O2 = CaO2 + 2H2O
reacție similară neutralizării unei baze cu un acid. Stabilitatea peroxizilor crește cu numărul atomic. Beriliul nu formează peroxid.
Prin combinarea cu apă a oxizilor rezultă hidroxizi. Solubilitatea și caracterul bazic al hidroxizilor se accentuează de la beriliu la bariu; hidroxidul de beriliu este amfoter, pe când hidroxidul de bariu este puternic bazic.
Metalele alcalino-pământoase propriu-zise (calciul, stronțiul, bariul) se pot combina cu hidrogenul formând hidruri:
Ca + H2 = CaH2
Aceste combinații au caracter ionic, hidrogenul fiind componentul electronegativ. Hidrura de magneziu se obține mai greu, iar hidrura de beriliu nici nu se poate obține pe cale directă. Aceste două hidruri nu au un caracter ionic atât de pronunțat ca hidrurile de calciu, stronțiu și bariu.
Elementele grupei a II-a principale formează săruri de tipul MIIX2, în care au rol de cationi bivalenți. Aceștia sunt incolori. Beriliul poate forma și combinații în care intră în compoziția anionului, de exemplu [BeO2]2-, sau [Be(OH)4]2-.
Calciul, stronțiul și bariul, sub formă de combinații volatile, colorează flacăra caracteristic: calciul în cărămiziu, stronțiul în roșu-carmin și bariul în galben-verzui.
Dintre toate metalele grupei a II-a principale, foarte mare importanță tehnică prezintă magneziul.