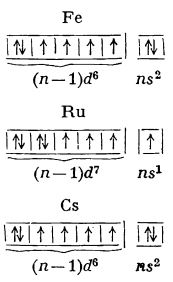
Grupa 8 a sistemului periodic, în trecut considerată parte a grupei a VIII-a secundare, alături de grupele 9 și 10, cuprinde elementele fier, Fe, ruteniu, Ru, și osmiu, Os.
Elementele acestei grupe au 8 electroni în straturile electronice ultim și penultim. Repartiția celor 8 electroni nu este însă uniformă în interiorul grupei, deci aceste elemente nu au o structură electronică unitară.
Datorită structurii electronice a elementelor din grupele 8, 9 și 10, în trecut, acestea au fost grupate împreună în grupa a VIII-a secundară. Deci se considera că grupa a VIII-a secundară a sistemului periodic cuprinde de trei ori câte trei elemente așezate consecutiv după numerele atomice (trei triade orizontale), și anume: fierul, Fe, cobaltul, Co, și nichelul, Ni (care au numerele atomice 44-46), ruteniul, Ru, rodiul, Rh, și paladiul, Pd (care au numerele atomice 44-46) și osmiul, Os, iridiul, Ir, și platina, Pt (care au numerele atomice 76-78). Primele trei formează grupa fierului, celelalte șase formează grupa metalelor platinice, care se studiau grupate în trei diade verticale (ruteniu-osmiu, rodiu-iridiu, paladiu-platina).
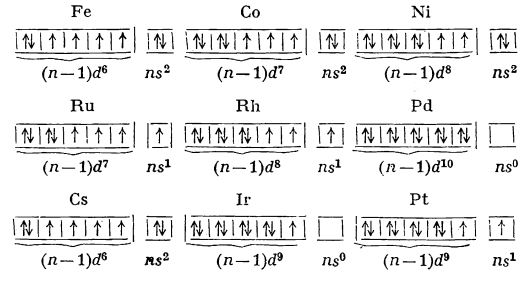
Elementele din grupa 8 sunt
elemente de tranziție. Datorită existenței celor 8 electroni (
n - 1)
d și
ns ar trebui să manifeste, teoretic, toate numerele de oxidare de la 1 la 8. Însă, numai la ruteniu și osmiu s-a observat, în unele cazuri, gradul de oxidare maxim opt. În general, tendința de a se manifesta în numere superioare de oxidare crește de sus în jos (în coloanele verticale) și de la dreapta la stânga (în rândurile orizontale) în tabelul periodic al elementelor.
Fierul apare în mod curent ca Fe(II) și Fe(III), ruteniul ca Ru(IV), iar osmiul ca Os(IV) și Os(VIII). Când manifestă grade inferioare de oxidare, până la +4, elementele grupei 8 formează combinații ionice. Când manifestă numere superioare de oxidare, ele formează combinații covalente. Elementele din această grupă pot forma și legături coordinative, atomul elementului având rol de acceptor. Valența coordinativă maximă este 8; obișnuit însă este 6 sau 4.
Caracteristicile elementelor din grupa 8
| Caracteristici |
Fe |
Ru |
Os |
| Numărul atomic |
27 |
44 |
76 |
| Configurația electronică exterioară |
3d64s2 |
4d75s1 |
5d66s2 |
| Masa atomică |
55,847 |
101,07 |
190,20 |
| Densitatea (s), g/cm3 |
7,86 |
12,2 |
22,6 |
| Punctul de topire, °C |
1535 |
2310 |
5027 |
| Punctul de fierbere, °C |
2750 |
3900 |
5027 |
| Potențialul de ionizare, eV |
7,89 |
7,5 |
8,7 |
| Electronegativitatea (Pauling) |
1,8 |
2,2 |
2,2 |
| Raza de covalență, Å |
1,39 |
1,38 |
1,40 |
| Raza ionică (pentru X3+), Å |
0,64 |
0,69 |
0,67 (Os4+) |
Elementele acestei grupe au caracter metalic, culoare albă-argintie, o structură cristalină stabilă, deci puncte de topire și, mai ales, de fierbere foarte ridicate. Volumele lor atomice sunt foarte mici. Comun acestor elemente este și proprietatea de a include hidrogen și de a-l activa. De asemenea, manifestă bune proprietăți catalitice.